Для поліпшення роботи сайту ми використовуємо файли cookie. Продовжуючи переглядати сайт, ви погоджуєтеся з цим.
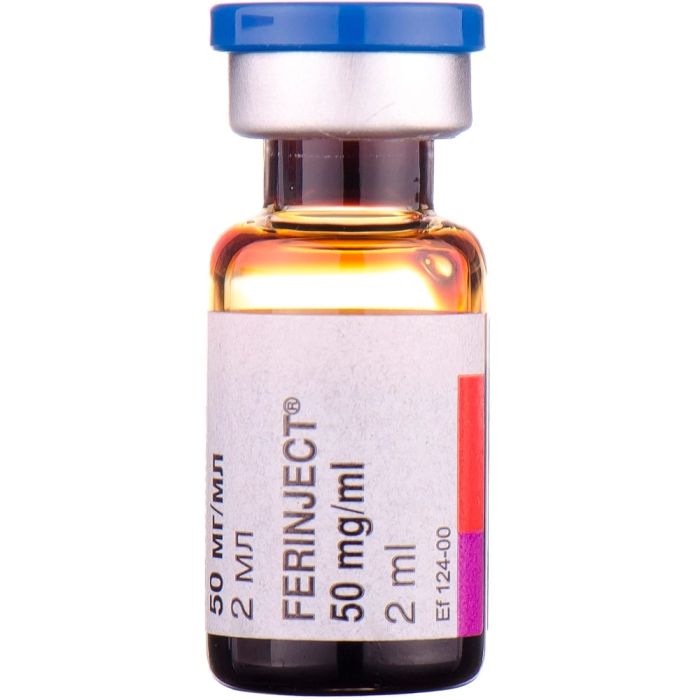
Феринжект 50 мг/мл розчин для ін'єкцій 2 мл №1
525,80 ₴
Vifor (International) (Швейцарія)
Арт.
783387

У список
Феринжект 50 мг/мл розчин для ін'єкцій 2 мл №1 Vifor (International) (Швейцарія)
Vifor (International) (Швейцарія)
-

 Значення "Можна" вказує на те, що вибраний препарат має мінімальний ризик для здоров'я дорослого населення і результат, очікуваний від вживання лікарського засобу, переважає над можливими ризиками. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Значення "Можна" вказує на те, що вибраний препарат має мінімальний ризик для здоров'я дорослого населення і результат, очікуваний від вживання лікарського засобу, переважає над можливими ризиками. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем. -


-
 Значення "Не можна" вказує на те, що вибраний препарат має максимальний ризик для здоров'я вагітних жінок і, відповідно, ризики від вживання даного лікарського препарату переважають над очікуваним результатом. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Значення "Не можна" вказує на те, що вибраний препарат має максимальний ризик для здоров'я вагітних жінок і, відповідно, ризики від вживання даного лікарського препарату переважають над очікуваним результатом. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем. -
 Значення "З обережністю" вказує на те, що вибраний препарат може чинити підвищений негативний вплив на здоров'я годуючих жінок, такі лікарські засоби рекомендується вживати, якщо очікуваний результат від застосування даного лікарського препарату переважає над всілякими ризиками. Щоб уникнути несприятливих наслідків, будь-який медикаментозний препарат слід вживати після консультації з провідним фахівцем.
Значення "З обережністю" вказує на те, що вибраний препарат може чинити підвищений негативний вплив на здоров'я годуючих жінок, такі лікарські засоби рекомендується вживати, якщо очікуваний результат від застосування даного лікарського препарату переважає над всілякими ризиками. Щоб уникнути несприятливих наслідків, будь-який медикаментозний препарат слід вживати після консультації з провідним фахівцем. -

 Значення "З обережністю" вказує на те, що вибраний препарат може чинити підвищений негативний вплив на здоров'я алергіків, такі лікарські засоби рекомендується вживати, якщо очікуваний результат від застосування цього лікарського препарату переважає над всілякими ризиками. Щоб уникнути несприятливих наслідків, будь-який медикаментозний препарат слід вживати після консультації з провідним фахівцем.
Значення "З обережністю" вказує на те, що вибраний препарат може чинити підвищений негативний вплив на здоров'я алергіків, такі лікарські засоби рекомендується вживати, якщо очікуваний результат від застосування цього лікарського препарату переважає над всілякими ризиками. Щоб уникнути несприятливих наслідків, будь-який медикаментозний препарат слід вживати після консультації з провідним фахівцем. -

 Значення "Можна" вказує на те, що вибраний препарат має мінімальний ризик для здоров'я діабетиків і результат, очікуваний від вживання лікарського засобу, переважає над можливими ризиками. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Значення "Можна" вказує на те, що вибраний препарат має мінімальний ризик для здоров'я діабетиків і результат, очікуваний від вживання лікарського засобу, переважає над можливими ризиками. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Залишилися питання?
Ми раді допомогти
Характеристики товара
| Виробник | Vifor (International) (Швейцарія) |
|---|---|
| Дозування | 50 мг/мл |
| Головний медикамент | Гідроксиду заліза (iii) полімальтозний комплекс |
| Форма товару | Розчин |
| Спосіб застосування | Внутрішньовенний |
| Країна виробництва | Швейцарія |
| Ознака | Імпортний |
| Штрих-код | 7640114725012 |
| Бренд | Ферінжект |
| Об'єм | 2 мл |
| Умови відпуску | за рецептом |
| Призначення | При дефіциті заліза |
| Температура зберiгання | не вище 30°C |
Інструкція

Оновлено: 04.02.2026
Перевірено
Інструкція
Феринжект (Ferinject) інструкція по застосуванню
Склад
Діюча речовина: залізо у вигляді заліза карбоксимальтози;
- 1 мл розчину містить 180 мг карбоксимальтози заліза, що еквівалентно 50 мг заліза;
Допоміжні речовини: натрію гідроксид і кислота хлористоводнева (для коригування рН), вода для ін'єкцій.
Лікарська форма
Розчин для ін'єкцій та інфузій.
Основні фізико-хімічні властивості: Непрозорий водяний розчин темнокоричневого кольору.
Фармако-терапевтична група
Антианемічні засоби. Препарати заліза. Препарати заліза для парентерального введення. Код АТХ В03А.
Фармакологічні властивості
Механізм дії
Після введення карбоксимальтозний комплекс заліза переважно засвоюється ретикулоендотеліальною системою печінки, кістковим мозком та селезінкою. Залізо використовується головним чином для синтезу гемоглобіну, міоглобіну та залізовмісних ферментів, а також залізо зберігається у печінці як депоноване.
Фармакодинаміка
Розчин препарату Ферінжект містить залізо в стабільному стані – комплекс заліза (III), що складається з полінуклеарного ядра гідроксиду заліза (III) з вуглеводним полімером, що постачає залізо, придатне до використання та транспортування заліза в організмі, та білки, що депонують залізо (Трансферрин та феритин) . У дослідженні з 59 Fe- та 52 Fe-міченим препаратом Ферінжект за участю 6 пацієнтів із залізодефіцитною анемією або нирковою анемією було виявлено засвоєння 61-99% заліза еритроцитами через 24 дні після введення препарату. У пацієнтів із залізодефіцитною анемією використання становило 91-99%, а у пацієнтів із нирковою анемією 61-84%.
Діти та підлітки віком 1–17 років
У проспективному фармакокінетичному/фармакодинамічному дослідженні фази 2 (1VIT13036) 35 дітей у групах з послідовним введенням доз отримували лікування шляхом внутрішньовенного введення одноразових доз лікарського засобу Феринжект 7,5 мг заліза/кг (n = 16) та Феринжект 15 мг заліза/кг (n = 19) (максимальна доза становить 750 мг заліза). На 35-й день після ін’єкції середнє підвищення (стандартне відхилення [СВ]) гемоглобіну становило 1,9 (1,38) г/дл при застосуванні 7,5 мг заліза/кг та 2,8 (1,15) г/дл при застосуванні 15 мг заліза/кг відповідно. Насичення феритину та трансферину також збільшувалося залежно від дози.
Ефективність та безпеку внутрішньовенного введення лікарського засобу Феринжект порівнювали з терапією пероральними препаратами заліза у проспективному відкритому дослідженні з паралельними групами фази 3 (1VIT17044). Сорок дітей із залізодефіцитною анемією різної етіології отримували 2 дози лікарського засобу Феринжект по 15 мг заліза/кг кожна з інтервалом 7 днів (максимальна одноразова доза становить 750 мг), а 39 дітей отримували сульфат заліза перорально протягом 28 днів. Семеро дітей, які належним чином не відповіли на терапію пероральним препаратом заліза, також отримували 2 дози лікарського засобу Феринжект у розширеному дослідженні з однією групою (1VIT18045).
В основному дослідженні спостерігалося клінічно значуще підвищення рівня гемоглобіну в обох групах лікування. Середнє підвищення рівня гемоглобіну (за методом найменших квадратів) становило 2,22 г/дл (95 % ДІ: 1,69–2,75) після застосування лікарського засобу Феринжект та 1,92 г/дл (95 % ДІ: 1,43–2,41) після терапії пероральними препаратами заліза без статистично значущої різниці між групами лікування. Таким чином, первинна кінцева точка дослідження не була досягнута. Підвищення вторинних кінцевих точок (рівень феритину та насичення трансферину) було більшим при застосуванні лікарського засобу Феринжект, ніж після терапії пероральним препаратом заліза. У розширеному дослідженні середнє підвищення [СВ] рівня гемоглобіну від закінчення основного дослідження становило 0,7 (1,19) г/дл.
Фармакокінетика
Поділ
Після введення разової дози препарату Ферінжект, що містить від 100 до 1000 мг заліза пацієнтам, із залізодефіцитною анемією пікові рівні загального заліза у сироватці крові від 37 до 333 мкг/мл досягалися протягом 15 хвилин та 1,21 години відповідно. Об'єм розподілу центрального компартменту відповідав обсягу плазми (близько 3 л).
Позитрононемісійна томографія показала, що залізо радіоміченого препарату Ферінжект виводиться з крові, потрапляє в кістковий мозок та ретикулоендотеліальну систему печінки та селезінки.
Метаболізм
Карбоксимальтозне залізо головним чином поглинається ретикулоендотеліальною системою печінки, кісткового мозку та незначною селезінкою і розпадається на гідроксид заліза та вуглеводи, причому залізо зв'язується, формуючи феритин. Залізо стає доступним для еритропоезу через трансферин, якщо це необхідно. Вуглеводні розпаду являють собою мальтотетраоз, мальтотріоз, мальтозу та глюкозу.
Елімінація
Плазматичний кліренс введеного заліза швидкий, з кінцевим періодом напіввиведення від 7 до 12 годин та середнім вмістом препарату від 11 до 18 годин.
Кінетика у особливих груп пацієнтів
Діти віком 1‒17 років
Фармакокінетику введеної внутрішньовенно карбоксимальтози заліза досліджували у дітей віком від 1 року із залізодефіцитною анемією у фармакокінетичному/фармакодинамічному дослідженні фази 2 1VIT13036 із застосуванням одноразових доз, що було доповнено популяційним фармакокінетичним аналізом, який включав додаткові вибіркові фармакокінетичні зразки з клінічного дослідження фази 3 1VIT17044. Фармакокінетичні властивості при рівні дози 15 мг заліза/кг (максимальна одноразова доза становить 750 мг) були подібними до таких у дорослих пацієнтів з дефіцитом заліза, які отримували рекомендовану дозу для дорослих. Рівень заліза в сироватці крові підвищувався пропорційно до дози при застосуванні одноразових доз 7,5 мг заліза/кг та 15 мг заліза/кг. Після введення одноразової дози лікарського засобу Феринжект 15 мг заліза/кг маси тіла (максимальна доза становить 750 мг) середній максимальний рівень загального заліза в сироватці кровіт 310 мкг/мл визначався через 1,12 години. Кінцевий період напіввиведення становив 9,8 години, а об’єм розподілу, розрахований за даними популяційного фармакокінетичного аналізу, становив від 0,42 до 3,14 л.
Порушення функції печінки
Дослідження за участю пацієнтів із печінковою недостатністю не проводилися.
Клінічні властивості
Показання
Застосування препарату показано пацієнтам у разі недостатньої ефективності, неефективності або неможливості перорального прийому залізовмісних препаратів, наприклад, у зв'язку з непереносимістю пероральних препаратів заліза або за наявності захворювань шлунково-кишкового тракту (таких як виразковий коліт), коли пероральні препарати заліза можуть з хвороби, або при резистентному до терапії залізодефіцитного стану, коли є підозра, що препарати заліза не застосовують належним чином.
Протипоказання Феринжекту
- гіперчутливість до активної речовини або до інших компонентів препарату;
- анемія без підтвердженого дефіциту заліза;
- наявність ознак перенасичення організму залізом;
- І триместр вагітності.
Взаємодія з іншими лікарськими засобами та іншими видами взаємодій.
Препарат не слід застосовувати одночасно з пероральними залізовмісними засобами, оскільки абсорбція заліза, що застосовується внутрішньо, знижується (див. розділ «Особливості застосування»).
Особливості застосування препарату
Ферінжект слід застосовувати тільки тоді, коли діагноз залізодефіцитного стану встановлений та підтверджений відповідними лабораторними дослідженнями (наприклад, визначення рівня таких показників, як рівень феритину в плазмі, насичення трансферину (TSAT), гемоглобін (Hb), гематокрит, кількість еритроцитів MCV) та середній вміст гемоглобіну в еритроцитах (MCH).
Реакції гіперчутливості
Внутрішньовенне застосування препаратів заліза може призвести до виникнення реакцій гіперчутливості негайного типу (анафілактоїдних/анафілактичних реакцій), які можуть бути летальними.
Повідомлялося про виникнення таких реакцій навіть у випадках, коли попереднє застосування заліза для парентерального введення проходило без ускладнень. Надходили повідомлення про реакції гіперчутливості, які могли прогресувати до синдрому Коуніса (гострий алергічний спазм коронарних артерій, що може призвести до інфаркту міокарда). Лікування препаратом Ферінжект повинен призначати черговий лікар лише після точного визначення показання.
Феррінжект можна вводити лише за умови, що медичний персонал, який має навички оцінки та лікування анафілактичних реакцій, готовий до негайних дій, та за наявності приміщення, обладнаного належним чином засобами для проведення реанімаційних заходів. Перед кожним застосуванням препарату Феринжект слід опитати пацієнта щодо попереднього виникнення побічних реакцій, пов'язаних із застосуванням препаратів заліза для внутрішньовенного введення.
Типовими симптомами гострих реакцій гіперчутливості є: зниження АТ, тахікардія (і навіть анафілактичний шок), респіраторні симптоми (включаючи бронхоспазм, набряк гортані та фарингеальний набряк), симптоми з боку шлунково-кишкового тракту (включаючи абдомін шкіри, включаючи крапив) .
Кожному пацієнту слід обстежити прояви побічних реакцій не менше ніж через 30 хвилин після кожного внутрішньовенного введення препаратів, що містять залізо. При виникненні алергічних реакцій або ознак непереносимості при введенні препарату лікування слід негайно припинити.
Для екстреної терапії гострих анафілактичних/анафілактоїдних реакцій рекомендується передусім адреналін, наприклад, 0,3 мг внутрішньом'язово. І тільки потім антигістамінні препарати та/або кортикостероїди (мають пізніший початок дії).
У поодиноких випадках спостерігалася лихоманка або уповільнені алергічні реакції (із затримкою на кілька годин або навіть днів).
Високий ризик виникнення реакцій гіперчутливості у пацієнтів з наявною алергією, включаючи непереносимість лікарського засобу, тяжкий перебіг бронхіальної астми в анамнезі, екземою та іншими формами атопії, а також у пацієнтів з імунологічними та запальними захворюваннями (наприклад, системний червоний вовчак).
Гіпофосфатемія/гіпофосфатемічна остеомаляція
Застосування парентеральних препаратів заліза може спричинити гіпофосфатемію, яка у більшості випадків тимчасова та протікає без клінічних симптомів. Повідомляли про окремі випадки гіпофосфатемії, які потребували медичної допомоги, головним чином у пацієнтів з факторами ризику та після тривалого застосування більш високих доз.
У післяреєстраційний період повідомляли про випадки гіпофосфатемії з клінічними проявами, що призводило до гіпофосфатемічної остеомаляції та переломів, які потребували клінічного втручання, у тому числі оперативного лікування. Пацієнтів слід інформувати про необхідність звернення до лікаря з появою артралгії чи болю у кістках.
За пацієнтами, які отримують багаторазові підвищені дози в рамках тривалого лікування та мають фактори ризику (наприклад дефіцит вітаміну D, порушення всмоктування кальцію та фосфатів, вторинний гіперпаратиреоз, спадкова геморагічна телеангіектазія, запальне захворювання кишечника та остеопороз), слід спостерігати за виникненням фосфатів. У разі стійкої гіпофосфатемії лікування препаратом Ферінжект слід переглянути.
Печінкова або ниркова недостатність
Пацієнтам із порушенням функції печінки препарати заліза для парентерального введення слід застосовувати після ретельної оцінки співвідношення користь/ризик.
Слід уникати парентерального введення заліза пацієнтам з порушеною функцією печінки, причиною якої є перенасичення залізом, особливо при пізній шкірній порфірії, та при будь-якому гострому порушенні з боку печінки.
Необхідно ретельно контролювати рівень заліза, щоб уникнути перенасичення залізом.
Інфекції
Залізо для парентерального введення застосовують з обережністю пацієнтам із гострою або хронічною інфекцією, бронхіальною астмою, екземою або атопічними алергіями. Рекомендується припинити лікування препаратом Ферінжект пацієнтам з бактеріємією, що триває.
Екстравазація
Слід уникати паравенозних витоків. Це може спричинити подразнення шкіри та тривале забарвлення місця ін'єкції/інфузії у коричневий колір. У разі паравенозного закінчення лікарського засобу ферінжект слід негайно припинити його введення.
Інші компоненти
1 мл препарату Ферінжект може містити до 5,5 мг (0,24 ммоль) натрію. Це необхідно враховувати пацієнтам, які дотримуються дієти з контролем натрію.
Застосування у період вагітності або годування груддю
Вагітність
На сьогоднішній день є обмежена кількість клінічних даних щодо застосування препарату Ферінжект. Слід оцінювати співвідношення ризик/користування перед застосуванням препарату протягом періоду вагітності, оскільки реакції гіперчутливості можуть нести певний ризик для матері та дитини (див. розділ «Особливості застосування»).
Препарат Ферінжект протипоказаний застосовувати у І триместрі вагітності (див. розділ «Протипоказання»). Можливе застосування препарату у ІІ та ІІІ триместрах вагітності лише суворо за показаннями. При застосуванні препарату у ІІ та ІІІ триместрах вагітності слід враховувати дані про масу тіла до початку вагітності для розрахунку необхідної кількості заліза, щоб уникнути передозування. Під час та після застосування препарату Ферінжект слід спостерігати за вагітними щодо виникнення симптомів реакцій гіперчутливості.
Після введення парентеральних препаратів заліза може виникнути брадикардія плода, зазвичай має транзиторний характер і є наслідком реакції гіперчутливості у матері. Під час введення парентеральних препаратів заліза вагітним слід ретельно контролювати стан ненародженої дитини.
Годування груддю
Існує невеликий клінічний досвід застосування препарату під час годування груддю. Одне клінічне дослідження показало, що ризик впливу на дитину малоймовірний при застосуванні в терапевтичних дозах згідно з обмеженими даними про застосування препарату під час годування груддю.
Фертильність
Клінічних даних про вплив препарату Ферінжект на фертильність немає.
Здатність впливати на швидкість реакції при керуванні автотранспортом чи іншими механізмами.
Відповідних досліджень немає. Вплив на швидкість реакції при керуванні автотранспортом або іншими механізмами є малоймовірним.
Спосіб застосування та дози Феринжект
Під час та після кожного введення лікарського засобу Ферінжект слід спостерігати за пацієнтами щодо виникнення ознак та симптомів реакцій гіперчутливості.
Ферінжект можна вводити лише за умови, що медичний персонал, який має досвід оцінки та лікування анафілактичних реакцій, готовий до негайних дій, та за наявності приміщення, обладнаного належним чином засобами для проведення реанімаційних заходів. Пацієнта слід спостерігати щодо проявів побічних ефектів не менше 30 хвилин після кожного введення лікарського засобу Ферінжект (див. розділ «Особливості застосування»).
Дозування
Дозування лікарського засобу Ферінжект проводиться в кілька етапів: [1] визначення індивідуальної потреби в залізі, [2] розрахунок та введення доз заліза та [3] перевірка запасів заліза після поповнення.
Крок 1. Розрахунок необхідної кількості заліза
Індивідуальну кількість заліза, необхідну для поповнення запасів заліза із застосуванням лікарського засобу Ферінжект, можна визначити на основі маси тіла пацієнта та рівня гемоглобіну (Hb). Потребу в залозі слід визначати за формулою Ганзон (таблиця 1) або за спрощеною схемою дозування (таблиця 2).
Використання формули Ганзоні рекомендується для пацієнтів, які потребують дози, адаптованих до їх індивідуальних потреб, наприклад, пацієнтам з нервовою анорексією, кахексією, ожирінням або вагітним жінкам. Дефіцит заліза має бути підтверджений лабораторними дослідженнями згідно з показаннями.
Таблиця 1
Визначення потреби у залізі за формулою Ганзони
|
Маса тіла |
Hb (г/дл) |
|||
|
[кг] |
6 |
7,5 |
9 |
10,5 |
|
30 |
18 мл (900 мг) |
16 мл (800 мг) |
14 мл (700 мг) |
12 мл (600 мг) |
|
35 |
24 мл (1200 мг) |
22 мл (1100 мг) |
20 мл (1000 мг) |
16 мл (800 мг) |
|
40 |
26 мл (1300 мг) |
24 мл (1200 мг) |
20 мл (1000 мг) |
18 мл (900 мг) |
|
45 |
28 мл (1400 мг) |
26 мл (1300 мг) |
22 мл (1100 мг) |
18 мл (900 мг) |
|
50 |
30 мл (1500 мг) |
28 мл (1400 мг) |
24 мл (1200 мг) |
20 мл (1000 мг) |
|
55 |
32 мл (1600 мг) |
28 мл (1400 мг) |
24 мл (1200 мг) |
20 мл (1000 мг) |
|
60 |
34 мл (1700 мг) |
30 мл (1500 мг) |
26 мл (1300 мг) |
22 мл (1100 мг) |
|
65 |
38 мл (1900 мг) |
32 мл (1600 мг) |
28 мл (1400 мг) |
24 мл (1200 мг) |
|
70 |
42 мл (2100 мг) |
36 мл (1800 мг) |
32 мл (1600 мг) |
26 мл (1300 мг) |
|
75 |
44 мл (2200 мг) |
38 мл (1900 мг) |
32 мл (1600 мг) |
28 мл (1400 мг) |
|
80 |
46 мл (2300 мг) |
40 мл (2000 мг) |
34 мл (1700 мг) |
28 мл (1400 мг) |
|
85 |
48 мл (2400 мг) |
42 мл (2100 мг) |
36 мл (1800 мг) |
30 мл (1500 мг) |
|
90 |
50 мл (2500 мг) |
44 мл (2200 мг) |
36 мл (1800 мг) |
30 мл (1500 мг) |
Hb = гемоглобін
При масі тіла ≤ 66 кг розраховану загальну кумулятивну дозу слід округлити у меншу сторону до найближчих 100 мг заліза.
При масі тіла >66 розраховану загальну кумулятивну дозу слід округлити на більшу сторону до найближчих 100 мг заліза.
Формула Ганзоні:
Загальний дефіцит заліза [мг] = загальна кумулятивна доза [мг] =
Маса тіла(A) [кг] × (цільовий рівень Hb(B) – фактичний рівень Hb)(C) [г/дл] × 2,4(D) + депоноване залізо(E) [мг].
(A) Для пацієнтів із надмірною масою тіла рекомендується використовувати ідеальну масу тіла, для вагітних – масу тіла до вагітності. Існують різні способи визначення ідеальної маси тіла, наприклад розрахунок маси тіла, що відповідає індексу маси тіла (ІМТ) 25: ідеальна маса тіла = 25 (зростання в метрах) 2.
(B) Стандартний цільовий рівень гемоглобіну для формули Ганзон становить 15 г/дл. У особливих випадках, наприклад, для вагітних, слід встановлювати нижчий цільовий рівень гемоглобіну.
Ефективність лікування слід контролювати за наслідками аналізів крові. Для досягнення цільового рівня гемоглобіну може знадобитися коригування кумулятивної дози заліза.
(C) Для перерахунку гемоглобіну в ммоль/л на г/дл слід помножити показник гемоглобіну в ммоль/л на коефіцієнт 1,61145.
(D) Коефіцієнт 2,4 = 0,0034×0,07×10 000.
0,0034: вміст заліза у гемоглобіні становить 0,34%.
0,07: об'єм крові 70 мл/кг маси тіла 7% маси тіла.
10 000 = коефіцієнт для перекладу "г/дл" у "мг/д" (1 г/дл = 10 000 мг/л).
(E) Для пацієнтів з масою тіла > 35 кг кількість депонованого заліза становить 500 мг або більше. Величина депонованого заліза 500 мг відповідає нижній межі норми для жінок із низькими антропометричними характеристиками (мініатюрні жінки). Деякі посібники рекомендують визначати депоноване залізо з розрахунку 10–15 мг заліза/кг маси тіла.
Таблиця 2
Визначення потреб у залізі за спрощеною схемою дозування
|
Hb |
Маса тіла пацієнта |
|||
|
г/дл |
ммоль/л |
< 35 кг |
35 кг – < 70 кг |
≥ 70 кг |
|
< 10 |
< 6,2 |
500 мг |
1500 мг |
2000 мг |
|
10 – < 14 |
6,2 – < 8,7 |
500 мг |
1000 мг |
1500 мг |
|
≥ 14 |
≥ 8,7 |
500 мг |
500 мг |
500 мг |
Крок 2. Розрахунок та введення доз заліза
Ферінжект слід вводити у відповідних дозах залежно від певної необхідної кількості заліза. Використовуйте, як описано нижче.
Одноразова доза лікарського засобу Ферінжект не повинна перевищувати наступних величин:
- 15 мг заліза/кг маси тіла (при введенні шляхом внутрішньовенної ін'єкції) або
- 20 мг заліза/кг маси тіла (при введенні шляхом внутрішньовенної інфузії)
- 1000 мг заліза (20 мл лікарського засобу Ферінжект).
Максимальна кумулятивна доза лікарського засобу, що рекомендується, Ферінжект становить 1000 мг заліза (20 мл Ферінжект) на тиждень. Якщо кумулятивна доза заліза перевищує 20 мг заліза/кг маси тіла або 1000 мг заліза у лікарському засобі Ферінжект, дозу слід розділити на два введення з інтервалом не менше 1 тижня.
Крок 3. Перевірка запасів заліза після поповнення
Залежно стану конкретного пацієнта лікаря слід проводити повторні обстеження (включаючи аналізи крові). Рівень гемоглобіну слід повторно визначати не раніше ніж через 4 тижні після останнього введення лікарського засобу Феринжекту, щоб було достатньо часу для еритропоезу та утилізації заліза. Якщо пацієнт потребує подальшого поповнення запасів заліза, необхідно перерахувати потребу в залізі за формулою Ганзон або за спрощеною схемою дозування.
Спосіб введення
Ферінжект вводять виключно внутрішньовенно:
- шляхом ін'єкції або
- шляхом інфузії або
- у нерозведеному вигляді шляхом ін'єкції безпосередньо у венозну частину діалізатора під час процедури гемодіалізу.
Ферінжект не можна вводити внутрішньом'язово чи підшкірно.
Під час та після застосування препарату Ферінжект слід спостерігати за пацієнтами щодо виникнення симптомів гіперчутливості. Необхідно забезпечити проведення відповідної невідкладної терапії (див. розділ «Особливості застосування»).
Внутрішньовенна ін'єкція
Ферінжект може бути введений шляхом внутрішньовенної ін'єкції нерозведеного розчину. Максимальна допустима одноразова доза становить 15 мг заліза/кг маси тіла і не повинна перевищувати 1000 мг заліза. Швидкість уведення. у таблиці 3.
Таблиця 3
Швидкість введення для внутрішньовенної ін'єкції лікарського засобу Ферінжект
|
Необхідний об’єм лікарського засобу Феринжект |
Еквівалентна доза заліза |
Швидкість введення / мінімальний час введення |
||||
|
2 |
– |
4 мл |
100 |
– |
200 мг |
Немає вимоги щодо мінімального часу введення |
|
> 4 |
– |
10 мл |
> 200 |
– |
500 мг |
100 мг заліза/хвилину |
|
> 10 |
– |
20 мл |
> 500 |
– |
1000 мг |
15 хвилин |
Внутрішньовенна інфузія
Ферінжект може бути введений шляхом внутрішньовенної інфузії і в цьому випадку його необхідно розводити. Максимальна допустима одноразова доза становить 20 мг заліза/кг маси тіла і не повинна перевищувати 1000 мг заліза. Для інфузій лікарський засіб Ферінжект слід розводити лише стерильним 0,9% (м/об) розчином натрію хлориду, як показано в таблиці 4. Примітка: для забезпечення стабільності не допускається розведення лікарського засобу Ферінжект до концентрації менше 2 мг заліза/мл (не рахуючи) об'єм розчину заліза (карбоксимальтози у флаконі). Додатково щодо розведення цього лікарського засобу перед введенням див. нижче «Інструкції щодо обігу».
Таблиця 4
План розведення лікарського засобу Ферінжект для внутрішньовенної інфузії
|
Необхідний об’єм лікарського засобу Феринжект |
Еквівалентна доза заліза |
Максимальний об’єм стерильного 0,9 % (м/об) розчину натрію хлориду |
Мінімальний час введення |
||||
|
2 |
– |
4 мл |
100 |
– |
200 мг |
50 мл |
Немає вимоги щодо мінімального часу введення |
|
> 4 |
– |
10 мл |
> 200 |
– |
500 мг |
100 мл |
6 хвилин |
|
> 10 |
– |
20 мл |
> 500 |
– |
1000 мг |
250 мл |
15 хвилин |
Інструкції з поводження
Флакони призначені лише для одноразового використання.
Перед застосуванням препарату необхідно візуально перевірити флакони на наявність видимих частинок та пошкоджень.
Слід використовувати лише флакони з однорідним розчином без видимих частинок.
Ферінжект можна змішувати тільки зі стерильним 0,9% (м/об) розчином хлориду натрію. Інші внутрішньовенні розчини для розведення та лікарські засоби не можна використовувати через ризик утворення осаду та/або взаємодії.
Особливі групи пацієнтів
Для дітей віком до 1 року
Ефективність та безпека застосування лікарського засобу Феринжект дітям віком до 1 року не досліджувалися, тому не рекомендується застосовувати цей лікарський засіб дітям цієї вікової категорії.
Діти віком ≥ 1 року
Лікарський засіб Феринжект не схвалений для застосування дітям віком від 1 до 18 років через обмеженість даних.
Рекомендації щодо дозування не можуть бути надані. Наявні на даний час дані щодо застосування дітям описані в розділах «Фармакологічні властивості» та «Побічні реакції».
Пацієнти з хронічним захворюванням нирок, які потребують гемодіалізу
Для пацієнтів із хронічними захворюваннями нирок, які потребують гемодіалізу, максимальна доза, що вводиться, не повинна перевищувати 200 мг заліза 1 раз на добу.
Ефективність та безпека застосування лікарського засобу Феринжект дітям із хронічними захворюваннями нирок, які потребують гемодіалізу, не досліджувалися. Тому не рекомендується застосовувати лікарський засіб Феринжект дітям із хронічними захворюваннями нирок, які потребують гемодіалізу.
Пацієнти з порушеннями з боку печінки
Відсутній досвід застосування лікарського засобу Феринжект пацієнтам із порушеннями функції печінки.
Діти.
Ефективність та безпека застосування препарату Феринжект дітям та підліткам не досліджувалися, тому не рекомендується застосовувати препарат пацієнтам цієї вікової категорії. Наявні на даний час дані щодо застосування дітям описані в розділах «Фармакологічні властивості» та «Побічні реакції».
Передозування
Випадкове перевищення загальної кумулятивної дози, необхідної для корекції дефіциту заліза у пацієнта, може призвести до накопичення заліза у його запасах та, зрештою, до гемосидерозу у таких пацієнтів. Це можна запобігти шляхом профілактичного контролю параметрів заліза - сироваткового феритину та насичення трансферину. Небажане накопичення заліза слід лікувати відповідно до стандартної медичної практики.
Побічні реакції Феринжекту
Про наведені нижче побічні реакції повідомляли у клінічних дослідженнях за участю 9456 дорослих пацієнтів та 82 дітей віком ≥ 1 року, які застосовували лікарський засіб Феринжект, а також під час постмаркетингового застосування.
Небажані ефекти за частотою виникнення класифікують за такими категоріями: часто (< 1/10 — ≥ 1/100), нечасто (< 1/100 — ≥ 1/1000), рідко (< 1/1000 — ≥ 1/10000) та невідомо (не можна оцінити на основі наявних даних). До найбільш частих небажаних реакцій належать нудота, реакція в місці ін’єкції/інфузії, гіпофосфатемія, головний біль, гіперемія обличчя, запаморочення, артеріальна гіпертензія.
До найбільш важливих серйозних побічних реакцій, виникнення яких асоціювалось із застосуванням препарату Феринжект, належать реакції гіперчутливості, які є нечастими (див. нижче реакції з боку імунної системи).
Найбільш серйозними побічними реакціями булі анафілактичні реакції (рідко): повідомляли про летальні випадки.
У клінічних дослідженнях у пацієнтів із виявленим зниженням сироваткових рівнів фосфатів найнижчі показники визначалися приблизно через 2 тижні. У більшості випадків показники нормалізувалися до початкових значень протягом 12 тижнів після лікування препаратом Феринжект.
Профіль безпеки у дітей віком 1‒17 років вивчали у наведених нижче дослідженнях.
У проспективному фармакокінетичному/фармакодинамічному дослідженні фази 2 (1VIT13036) 35 дітей у групах з послідовним введенням доз отримували лікування шляхом внутрішньовенного введення одноразових доз лікарського засобу Феринжект 7,5 мг заліза/кг (n = 16) та Феринжект 15 мг заліза/кг (n = 19) (максимальна доза становить 750 мг заліза). Не спостерігалося неочікуваних побічних реакцій на лікарський засіб порівняно з дорослими. Найбільш частими побічними реакціями були по 2 випадки пірексії та висипу при застосуванні лікарського засобу Феринжект 7,5 мг заліза/кг та по 3 випадки ринореї та кропив’янки, а також по 2 випадки пірексії та інфекції верхніх дихальних шляхів при застосуванні лікарського засобу Феринжект 15 мг заліза/кг.
У проспективному відкритому дослідженні з паралельними групами фази 3 (1VIT17044) 40 дітей отримували 2 дози лікарського засобу Феринжект по 15 мг заліза/кг кожна з інтервалом 7 днів (максимальна одноразова доза становить 750 мг). Не спостерігалося неочікуваних побічних реакцій на лікарський засіб порівняно з дорослими. Найбільш частими побічними реакціями після внутрішньовенної терапії лікарським засобом Феринжект були гіпофосфатемія/зниження рівня фосфатів у сироватці крові (n = 5), блювання (n = 2), головний біль (n = 2) та кропив’янка (n = 2).
При лабораторному біохімічному дослідженні виявлено потенційно клінічно значущу гіпофосфатемію у 8 пацієнтів, які застосовували лікарський засіб Феринжект (у тому числі 4 із зареєстрованих випадків побічних реакцій). Найнижчий рівень фосфатів зазвичай визначався через 2 тижні після початку терапії і в основному нормалізувався на 35-й день після початку лікування. Усі випадки гіпофосфатемії були безсимптомними.
Див. також розділ «Особливості застосування».
З боку імунної системи
Нечасто: реакції гіперчутливості негайного типу (анафілактична реакція) можуть призвести до летального наслідку (див. розділ «Особливості застосування»). Симптоми анафілактичних реакцій включають циркуляторний колапс, артеріальну гіпотензію, тахікардію, респіраторні симптоми (бронхоспазм, набряк гортані, фарингеальний набряк), симптоми з боку шлунково-кишкового тракту (абдомінальні спазми, блювання), симптоми з боку шкіри (кропив’янка, еритема, свербіж).
Метаболізм та порушення харчування
Часто: гіпофосфатемія (на основі лабораторних даних).
З боку психіки
Рідко: відчуття тривоги.
З боку нервової системи
Часто: головний біль, запаморочення.
Нечасто: спотворення смаку (дисгевзія), парестезія.
Невідомо: втрата свідомості.
З боку серця
Нечасто: тахікардія.
З боку судинної системи
Часто: артеріальна гіпертензія, припливи.
Нечасто: артеріальна гіпотензія.
Рідко: запаморочення, втрата свідомості, флебіт.
З боку дихальної системи, органів грудної клітки та середостіння
Нечасто: задишка.
Рідко: бронхоспазм.
З боку травної системи
Часто: нудота.
Нечасто: абдомінальний біль, блювання, запор, діарея, диспепсія.
Рідко: метеоризм.
З боку печінки та жовчного міхура
Нечасто: підвищення рівня аланінамінотрансферази (АлАТ), підвищення рівня аспартатамінотрансферази (АсАТ), підвищення рівня гамма-глутамілтрансферази (γ-ГТ), підвищення рівня лужної фосфатази (ЛФ), підвищення рівня лактатдегідрогенази (ЛДГ).
З боку шкіри та підшкірних тканин
Нечасто: висипання (включає такі реакції: еритематозний, генералізований, макульозний, макулопапульозний, сверблячий висип), свербіж, кропив’янка, еритема.
Рідко: ангіоневротичний набряк, віддалене знебарвлення шкіри, блідість.
Невідомо: дерматит, набряк обличчя.
З боку кістково-м’язової системи і сполучної тканини
Нечасто: артралгія, міалгія, біль у кінцівках, біль у спині, м’язові спазми.
Невідомо: гіпофосфатемічна остеомаляція.
Загальні порушення та реакції у місці введення
Часто: реакції у місці ін’єкції/інфузії (включаючи такі симптоми, як біль, гематома, зміна кольору (потенційно тривала), екстравазація, подразнення, флебіт та пареcтезія в місці ін’єкції/інфузії).
Нечасто: пірексія, втомлюваність, озноб, біль у грудях, периферичний набряк, біль, нездужання.
Рідко: грипоподібні захворювання (з початком у період від декількох годин до декількох днів).
Повідомлення про підозрювані побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності
3 роки.
Умови зберігання
Зберігати в оригінальній упаковці за температури понад 30 ºС. Не заморожувати. Зберігати у недоступному для дітей місці!
Несумісність
Ферінжект можна змішувати лише зі стерильним 0,9% розчином натрію хлориду. Сумісність із контейнерами, виготовленими з матеріалів, крім поліетилену та скла, не вивчена.
Упаковка
По 2 мл або 10 мл у флаконі. По 1 або 5 флаконів у картонній коробці.
Категорія відпуску з аптеки
За рецептом.
Відгуки користувачів
Цей продукт ще не має відгуків.
Залишити відгук
Дивіться інші товари у категорії:
Зверніть увагу
Інформація/інструкція до препарату носить ознайомчий характер і призначена виключно для інформаційних цілей.