Для поліпшення роботи сайту ми використовуємо файли cookie. Продовжуючи переглядати сайт, ви погоджуєтеся з цим.
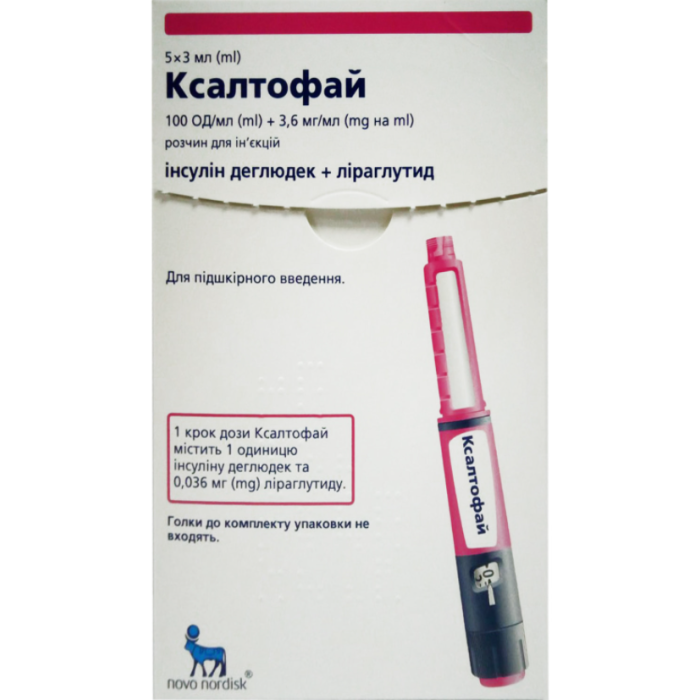
Ксалтофай 100 ОД/мл + 3,6 мг/мл розчин для ін'єкцій шприц-ручка 3 мл №5
8 468,80 ₴
Novo Nordisk (Данія)
Арт.
748152

У список
Ксалтофай 100 ОД/мл + 3,6 мг/мл розчин для ін'єкцій шприц-ручка 3 мл №5 Novo Nordisk (Данія)
Novo Nordisk (Данія)
Увага! Ціни дійсні тільки при покупці онлайн
Ваше місто - Київ?
Ваше місто
Харків
Товар відсутній в аптеках обраного міста

Самовивіз
Безкоштовно

Кур'єром
Доставка до 48 годин
Безкоштовно від 2000 грн
Рецептурний препарат. Можливий тільки самовивіз з аптеки

Нова Пошта відділення
Доставка від 1 дня
Від 80 грн

Нова Пошта поштомат
Доставка від 1 дня
Від 80 грн

Нова Пошта курʼєр
Доставка від 1 дня
Від 150 грн

Укрпошта відділення
Доставка від 2 днів
Від 52 грн
На сайті
При отриманні
-

 Значення "Можна" вказує на те, що вибраний препарат має мінімальний ризик для здоров'я дорослого населення і результат, очікуваний від вживання лікарського засобу, переважає над можливими ризиками. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Значення "Можна" вказує на те, що вибраний препарат має мінімальний ризик для здоров'я дорослого населення і результат, очікуваний від вживання лікарського засобу, переважає над можливими ризиками. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем. -


-
 Значення "Не можна" вказує на те, що вибраний препарат має максимальний ризик для здоров'я вагітних жінок і, відповідно, ризики від вживання даного лікарського препарату переважають над очікуваним результатом. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Значення "Не можна" вказує на те, що вибраний препарат має максимальний ризик для здоров'я вагітних жінок і, відповідно, ризики від вживання даного лікарського препарату переважають над очікуваним результатом. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем. -
 Значення "Не можна" вказує на те, що вибраний препарат має максимальний ризик для здоров'я годуючих жінок, і відповідно, ризики від вживання даного лікарського препарату переважають над очікуваним результатом. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Значення "Не можна" вказує на те, що вибраний препарат має максимальний ризик для здоров'я годуючих жінок, і відповідно, ризики від вживання даного лікарського препарату переважають над очікуваним результатом. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем. -

 Значення "З обережністю" вказує на те, що вибраний препарат може чинити підвищений негативний вплив на здоров'я алергіків, такі лікарські засоби рекомендується вживати, якщо очікуваний результат від застосування цього лікарського препарату переважає над всілякими ризиками. Щоб уникнути несприятливих наслідків, будь-який медикаментозний препарат слід вживати після консультації з провідним фахівцем.
Значення "З обережністю" вказує на те, що вибраний препарат може чинити підвищений негативний вплив на здоров'я алергіків, такі лікарські засоби рекомендується вживати, якщо очікуваний результат від застосування цього лікарського препарату переважає над всілякими ризиками. Щоб уникнути несприятливих наслідків, будь-який медикаментозний препарат слід вживати після консультації з провідним фахівцем. -

 Значення "З обережністю" вказує на те, що вибраний препарат може мати підвищений негативний вплив на здоров'я діабетиків, такі лікарські засоби рекомендується вживати, якщо очікуваний результат від застосування цього лікарського препарату переважає всілякі ризики. Щоб уникнути несприятливих наслідків, будь-який медикаментозний препарат слід вживати після консультації з провідним фахівцем.
Значення "З обережністю" вказує на те, що вибраний препарат може мати підвищений негативний вплив на здоров'я діабетиків, такі лікарські засоби рекомендується вживати, якщо очікуваний результат від застосування цього лікарського препарату переважає всілякі ризики. Щоб уникнути несприятливих наслідків, будь-який медикаментозний препарат слід вживати після консультації з провідним фахівцем.
Залишилися питання?
Ми раді допомогти
Характеристики товара
| Виробник | Novo Nordisk (Данія) |
|---|---|
| Головний медикамент | Інсулін деглюдек, ліраглутид |
| Форма товару | Шприц-ручка |
| Спосіб застосування | Підшкірний |
| Країна виробництва | Данія |
| Ознака | Імпортний |
| Штрих-код | 5712249115173 |
| Бренд | Ксалтофай |
| Об'єм | 3 мл |
| Умови відпуску | за рецептом |
| Призначення | Для діабетиків |
| Температура зберiгання | від 2°C до 8°C |
Інструкція

Оновлено: 29.01.2026
Перевірено
Інструкція
Ксалтофай (Xultophy) інструкція по застосуванню
Склад
діючі речовини: інсулін деглюдек, ліраглутид;
1 мл розчину містить:
-
100 ОД інсуліну деглюдек* та 3,6 мг ліраглутиду*.
1 попередньо заповнена шприц-ручка містить:
-
3 мл, що еквівалентно 300 ОД інсуліну деглюдек та 10,8 мг ліраглутиду;
допоміжні речовини: гліцерин, фенол, цинку ацетат, кислота хлористоводнева (для корекції pH), натрію гідроксид (для корекції pH), вода для ін’єкцій.
*Вироблені за технологією рекомбінантної ДНК в Saccharomyces cerevisiae.
Лікарська форма
Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий, безбарвний, ізотонічний розчин.
Фармакотерапевтична група
Лікарські засоби, що застосовуються при цукровому діабеті. Інсуліни та аналоги тривалої дії для ін’єкцій.
Код АТХ A10A E56.
Фармакологічні властивості
Фармакодинаміка.
Механізм дії.
Ксалтофай є комбінованим лікарським засобом, що складається з інсуліну деглюдек і ліраглутиду, механізми дії яких доповнюють один одного, покращуючи глікемічний контроль.
Інсулін деглюдек – це базальний інсулін, який після підшкірної ін’єкції утворює розчинний мультигексамер. В результаті формується депо, з якого інсулін деглюдек безперервно і повільно всмоктується в кровоток, що спричиняє рівний та стійкий ефект зниження рівня глюкози в крові з низькою щоденною варіабельністю дії інсуліну.
Інсулін деглюдек специфічно зв’язується з рецептором інсуліну людини, забезпечуючи такий же фармакологічний ефект, що й інсулін людини.
Цукрознижувальний ефект інсуліну деглюдек полягає в сприянні поглинання глюкози після зв’язування інсуліну з рецепторами м’язових і жирових клітин, а також в одночасному пригніченні виділення глюкози з печінки.
Ліраглутид є аналогом глюкагоноподібного пептиду-1 (ГПП-1) з послідовністю амінокислот, що на 97 % гомологічна ГПП-1 людини, він зв’язується з рецептором ГПП-1 (ГПП-1Р) та активує його. Пролонгована дія введеного підшкірно ліраглутиду обумовлена трьома механізмами: самоасоціацією, що уповільнює всмоктування, зв’язуванням з альбуміном крові і підвищеною стійкістю до дії ферментів дипептидилпептидази 4 (ДПП-4) і нейтральної ендопептидази (НЕП), що забезпечує тривалий період напіввиведення лікарського засобу з плазми.
Дія ліраглутиду відбувається за рахунок його специфічної взаємодії з рецепторами ГПП-1 та сприяє покращенню глікемічного контролю шляхом зниження рівнів глюкози у крові натщесерце і після їди. Ліраглутид стимулює секрецію інсуліну і зменшує надмірно високу секрецію глюкагону глюкозозалежним шляхом. Таким чином, коли рівень глюкози у крові є високим, відбувається стимулювання секреції інсуліну і пригнічення секреції глюкагону. І навпаки, при гіпоглікемії ліраглутид послаблює секрецію інсуліну і не перешкоджає секреції глюкагону. Крім того, механізм зниження рівня глюкози у крові також обумовлений незначною затримкою спорожнення шлунку. Ліраглутид знижує масу тіла і зменшує масу жирової тканини завдяки механізмам, що включають зменшення відчуття голоду і зниження споживання енергії.
ГПП-1 є фізіологічним регулятором апетиту і споживання їжі, однак точний механізм його дії поки що не з’ясовано повністю. В ході досліджень на тваринах периферійне введення ліраглутиду призводило до поглинання препарату специфічними ділянками головного мозку, задіяних в процесах регуляції апетиту, у яких ліраглутид через специфічну активацію ГПП-1Р посилював сигнали насичення і послаблював сигнали голоду, тим самим спричиняючи зменшення маси тіла.
Рецептори ГПП-1 представлені також і у специфічних ділянках серця, судин, імунної системи і нирок. В експериментальних моделях атеросклерозу на мишах ліраглутид запобігав подальшому розвитку аортальної бляшки і знижував ступінь запалення у бляшці. Крім того, ліраглутид сприятливим чином впливав на ліпіди плазми крові. Ліраглутид не зменшував розмір вже наявних бляшок.
Фармакодинамічні ефекти.
Ксалтофай має стабільний фармакодинамічний профіль із тривалістю дії, що є результатом комбінованої дії інсуліну деглюдек і ліраглутиду, що дозволяє застосовувати Ксалтофай один раз на добу у будь-який час незалежно від прийому їжі. Ксалтофай покращує глікемічний контроль шляхом стійкого зниження рівнів глюкози у крові натщесерце і після всіх прийомів їжі.
Зниження рівня глюкози після прийому їжі було підтверджено в ході допоміжного дослідження тривалістю 4 години після стандартизованого прийому їжі у пацієнтів з незадовільним контролем при застосуванні монотерапії метформіном або його комбінації з піоглітазоном. Ксалтофай спричиняв більш значне зниження рівня глюкози у плазмі крові після прийому їжі (середній рівень за 4 години), ніж інсулін деглюдек. Результати застосування лікарського засобу Ксалтофай та ліраглутиду були однаковими.
Клінічна ефективність і безпека.
Безпека та ефективність лікарського засобу Ксалтофай оцінювались в ході 6 рандомізованих контрольованих досліджень фази 3 у паралельних групах за участю різних популяцій пацієнтів з діабетом 2-го типу залежно від попередньої протидіабетичної терапії. Терапія препаратами порівняння включала застосування базального інсуліну, агоністів рецепторів ГПП-1, плацебо і базально-болюсного режиму. Випробування тривали 26 тижнів із рандомізацією від 199 до 833 пацієнтів для прийому лікарського засобу Ксалтофай. Одне дослідження було далі подовжене до 52 тижнів. В усіх дослідженнях початкова доза лікарського засобу визначалася згідно з інструкцією для медичного застосування; і двічі на тиждень здійснювалося титрування дози лікарського засобу Ксалтофай (див. таблицю 1). Такий же алгоритм титрування дози використовувався і при застосуванні препаратів порівняння – базальних інсулінів. В ході 5 досліджень Ксалтофай продемонстрував клінічно і статистично значуще покращення глікемічного контролю проти препаратів порівняння за рівнем глікозильованого гемоглобіну A1c (HbA1c), тоді як в одному дослідженні було продемонстровано однакове зниження HbA1c в обох групах лікування.
Таблиця 1. Титрування дози лікарського засобу Ксалтофай.
|
Рівень глюкози у плазмі крові перед сніданком*, |
Корекція дози (двічі на тиждень) |
|
|
ммоль/л |
мг/дл |
Ксалтофай (кроки дози) |
|
< 4,0 |
< 72 |
˗2 |
|
4,0˗5,0 |
72˗90 |
0 |
|
> 5,0 |
> 90 |
+2 |
* Рівні глюкози, виміряні пацієнтом самостійно. В ході дослідження застосування лікарського засобу Ксалтофай, який додавався до препаратів сульфонілсечовини, цільовий рівень становив 4,0–6,0 ммоль/л.
Глікемічний контроль.
Додавання до пероральних цукрознижувальних лікарських засобів.
Додавання лікарського засобу Ксалтофай до метформіну або до комбінації метформіну і піоглітазоному в ході рандомізованого контрольованого дослідження відкритого типу тривалістю 26 тижнів дозволило 60,4 % пацієнтів, які застосовували Ксалтофай, досягнути цільового рівня HbA1c < 7 % без підтверджених епізодів гіпоглікемії через 26 тижнів лікування. Ця частка пацієнтів була суттєво більшою, ніж при застосуванні інсуліну деглюдек (40,9 %; відношення шансів (ВШ): 2,28; p < 0,0001), та схожою з часткою пацієнтів при застосуванні ліраглутиду (57,7 %; ВШ: 1,13; p = 0,3184).
Частота випадків підтвердженої гіпоглікемії була нижче при застосуванні лікарського засобу Ксалтофай, ніж при застосуванні інсуліну деглюдек, незалежно від ступеня глікемічного контролю.
Частота випадків тяжкої гіпоглікемії (що визначалася як епізод, при якому існує потреба у допомозі з боку іншої людини) на один пацієнто-рік експозиції (частка пацієнтів у відсотках) становила 0,01 (2 з 825 пацієнтів) при застосуванні лікарського засобу Ксалтофай, 0,01 (2 з 412 пацієнтів) при застосуванні інсуліну деглюдек та 0,00 (жодний із 412 пацієнтів) при застосуванні ліраглутиду. Частота випадків нічної гіпоглікемії була схожою при застосуванні лікарського засобу Ксалтофай та інсуліну деглюдек.
Взагалі, пацієнти, які приймали Ксалтофай, мали менше побічних ефектів з боку шлунково-кишкового тракту, ніж ті, хто отримували ліраглутид. Це може бути наслідком більш повільного (у порівнянні з монотерапією ліраглутидом) збільшення дози ліраглутиду як компонента лікарського засобу Ксалтофай протягом періоду початку лікування.
Рівень ефективності та безпеки лікарського засобу Ксалтофай залишався стабільним протягом періоду до 52 тижнів лікування. Зниження показника HbA1c від початкового рівня до 52-го тижня лікування становило 1,84 % при застосуванні лікарського засобу Ксалтофай при розрахованій різниці між групами лікування – 0,65 % у порівнянні з результатами застосування ліраглутиду (p < 0,0001) та – 0,46 % у порівнянні з результатами застосування інсуліну деглюдек (p < 0,0001). Маса тіла зменшилась на 0,4 кг з розрахованою різницею між результатами лікування лікарським засобом Ксалтофай та інсуліном деглюдек – 2,80 кг (p < 0,0001), а частота підтверджених випадків гіпоглікемії залишалася на рівні 1,8 явища на один пацієнто-рік експозиції, що свідчить про значне зниження загального ризику підтвердженої гіпоглікемії у порівнянні з застосуванням інсуліну деглюдек.
Застосування лікарського засобу Ксалтофай сумісно із сульфонілсечовиною або з комбінацією сульфонілсечовини з метформіном вивчалося в ході рандомізованого плацебо контрольованого подвійно сліпого дослідження тривалістю 26 тижнів.
Частота випадків тяжкої гіпоглікемії на один пацієнто-рік експозиції (частка пацієнтів у відсотках) становила 0,02 (2 з 288 пацієнтів) при застосуванні лікарського засобу Ксалтофай та 0,00 (жодний зі 146 пацієнтів) при застосуванні плацебо.
Таблиця 2. Результати через 26 тижнів. Додавання до пероральних цукрознижувальних лікарських засобів.
|
|
Додавання до метформіну ± піоглітазон |
Додавання до сульфонілсечовини ± метформін |
|||
|
|
Ксалтофай |
Інсулін деглюдек |
Ліраглутид |
Ксалтофай |
Плацебо |
|
N |
833 |
413 |
414 |
289 |
146 |
|
HbA1c, % Початок → кінець дослідження |
8,3→6,4 |
8,3→6,9 |
8,3→7,0 |
7,9→6,4 |
7,9→7,4 |
|
Середня зміна |
˗ 1,91 |
˗ 1,44 |
˗ 1,28 |
˗ 1,45 |
˗ 0,46 |
|
Розрахована різниця |
|
˗ 0,47AB [˗ 0,58; ˗ 0,36] |
˗ 0,64AB [˗ 0,75; ˗ 0,53] |
|
˗ 1,02AB [˗ 1,18; ˗ 0,87] |
|
Пацієнти (%), які досягли HbA1c < 7 % |
|
|
|
|
|
|
Усі пацієнти |
80,6 |
65,1 |
60,4 |
79,2 |
28,8 |
|
Розрахований показник відношення шансів |
|
2,38B [1,78; 3,18] |
3,26B [2,45; 4,33] |
|
11,95B [7,22; 19,77] |
|
Пацієнти (%), які досягли HbA1c £ 6,5 % |
|
|
|
|
|
|
Усі пацієнти |
69,7 |
47,5 |
41,1 |
64,0 |
12,3 |
|
Розрахований показник відношення шансів |
|
2,82B [2,17; 3,67] |
3,98B [3,05; 5,18] |
|
16,36B [9,05; 29,56] |
|
Частота випадків підтвердженої гіпоглікемії* на один пацієнто-рік експозиції (частка пацієнтів у %) |
1,80 (31,9 %) |
2,57 (38,6 %) |
0,22 (6,8 %) |
3,52 (41,7 %) |
1,35 (17,1 %) |
|
Розраховане співвідношення |
|
0,68AC [0,53; 0,87] |
7,61B [5,17; 11,21] |
|
3,74B [2,28; 6,13] |
|
Маса тіла, кг Початок → кінець дослідження |
87,2→86,7 |
87,4→89,0 |
87,4→84,4 |
87,2→87,7 |
89,3→88,3 |
|
Середня зміна |
˗ 0,5 |
1,6 |
˗ 3,0 |
0,5 |
˗ 1,0 |
|
Розрахована різниця |
|
˗ 2,22AB [˗ 2,64; ˗ 1,80] |
2,44B [2,02; 2,86] |
|
1,48B [0,90; 2,06] |
|
ГПН, ммоль/л Початок → кінець дослідження |
9,2→5,6 |
9,4→5,8 |
9,0→7,3 |
9,1→6,5 |
9,1→8,8 |
|
Середня зміна |
˗ 3,62 |
˗ 3,61 |
˗ 1,75 |
˗ 2,60 |
˗ 0,31 |
|
Розрахована різниця |
|
˗ 0,17 [˗ 0,41; 0,07] |
˗ 1,76B [˗ 2,0; ˗ 1,53] |
|
˗ 2,30B [˗ 2,72; ˗ 1,89] |
|
Доза в кінці дослідження Інсулін деглюдек, одиниць |
38 |
53 |
- |
28 |
- |
|
Ліраглутид, мг |
1,4 |
- |
1,8 |
1,0 |
- |
|
Розрахована різниця, доза інсуліну деглюдек |
|
˗ 14,90AB [˗ 17,14; |
|
|
- |
Зареєстровані показники перед початком, в кінці лікування та їхня зміна. Останні зареєстровані показники перенесені наперед. 95 % довірчий інтервал зазначений у квадратних дужках ([ ]).
* Підтверджена гіпоглікемія визначається як тяжка форма гіпоглікемії (епізод, при якому потрібна допомога з боку іншої людини) та/або легка гіпоглікемія (рівень глюкози у плазмі крові < 3,1 ммоль/л, незалежно від симптомів).
A Кінцеві точки з підтвердженою перевагою лікарського засобу Ксалтофай у порівнянні з препаратом порівняння;
B p < 0,0001;
C p < 0,05.
ГПН – рівень глюкози у плазмі крові натщесерце.
Перехід від терапії агоністами рецепторів ГПП-1.
В ході рандомізованого дослідження відкритого типу тривалістю 26 тижнів вивчався перехід з терапії агоністами рецепторів ГПП-1 на лікування лікарським засобом Ксалтофай у порівнянні із застосуванням незмінної терапії агоністами рецепторів ГПП-1 (дозування за інструкцією для медичного застосування) за участю пацієнтів з цукровим діабетом 2-го типу з незадовільним контролем при застосуванні агоніста рецепторів ГПП-1 та метформіну (74,2 %) або його комбінації з піоглітазоном (2,5 %), з сульфонілсечовиною (21,2 %) чи з обома препаратами (2,1 %).
Частота випадків тяжкої форми гіпоглікемії на один пацієнто-рік експозиції (частка пацієнтів у відсотках) становила 0,01 (1 з 291 пацієнта) при застосуванні лікарського засобу Ксалтофай та 0,00 (жодний зі 199 пацієнтів) при застосуванні агоністів рецепторів ГПП-1.
Таблиця 3. Результати через 26 тижнів. Перехід з терапії агоністами рецепторів ГПП-1.
|
|
Перехід з терапії агоністом рецепторів ГПП-1 |
|
|
|
Ксалтофай |
Агоніст рецепторів ГПП-1 |
|
N |
292 |
146 |
|
HbA1c, % |
|
|
|
Початок → кінець дослідження |
7,8→6,4 |
7,7→7,4 |
|
Середня зміна |
˗1,3 |
˗0,3 |
|
Розрахована різниця |
|
˗0,94AB[˗1,11; ˗0,78] |
|
Пацієнти (%), які досягли HbA1c < 7 % |
|
|
|
Усі пацієнти |
75,3 |
35,6 |
|
Розрахований показник відношення шансів |
|
6,84B [4,28; 10,94] |
|
Пацієнти (%), які досягли HbA1c £ 6,5 % |
|
|
|
Усі пацієнти |
63,0 |
22,6 |
|
Розрахований показник відношення шансів |
|
7,53B [4,58; 12,38] |
|
Частота випадків підтвердженої гіпоглікемії* на один пацієнто-рік експозиції (частка пацієнтів у %) |
2,82 (32,0 %) |
0,12 (2,8 %) |
|
Розраховане співвідношення |
|
25,36B [10,63; 60,51] |
|
Маса тіла, кг |
|
|
|
Початок → кінець дослідження |
95,6→97,5 |
95,5→94,7 |
|
Середня зміна |
2,0 |
˗0,8 |
|
Розрахована різниця |
|
2,89B [2,17; 3,62] |
|
ГПН, ммоль/л |
|
|
|
Початок → кінець дослідження |
9,0→6,0 |
9,4→8,8 |
|
Середня зміна |
˗2,98 |
˗0,60 |
|
Розрахована різниця |
|
˗2,64B [˗3,03; ˗2,25] |
|
Доза в кінці дослідження |
|
Доза агоніста рецепторів ГПП-1 повинна була залишатися незмінною з початку дослідження |
|
Інсулін деглюдек, одиниць |
43 |
|
|
Ліраглутид, мг |
1,6 |
|
|
Розрахована різниця, доза інсуліну деглюдек |
|
|
Зареєстровані показники перед початком, в кінці лікування та їхня зміна. Останні зареєстровані показники перенесені наперед. 95 % довірчий інтервал зазначений у квадратних дужках ([ ]).
* Підтверджена гіпоглікемія визначається як тяжка форма гіпоглікемії (епізод, при якому потрібна допомога з боку іншої людини) та/або легка гіпоглікемія (рівень глюкози у плазмі крові < 3,1 ммоль/л, незалежно від симптомів).
A Кінцеві точки з підтвердженою перевагою лікарського засобу Ксалтофай у порівнянні з препаратом порівняння; B p < 0,001.
Перехід з терапії базальним інсуліном.
В ході дослідження тривалістю 26 тижнів вивчався перехід з терапії інсуліном гларгін (100 ОД/мл) на лікування лікарським засобом Ксалтофай у порівнянні з інтенсифікацією застосування інсуліну гларгін пацієнтам з незадовільним контролем при застосуванні інсуліну гларгін (20–50 одиниць) та метформіну. Застосована в ході цього дослідження максимально допустима доза лікарського засобу Ксалтофайстановила 50 кроків дози, тоді максимальна доза інсуліну гларгін не встановлювалася. У 54,3 % пацієнтів, які приймали Ксалтофай, було досягнуто цільовий рівень HbA1c < 7 % без підтверджених епізодів гіпоглікемії, у порівнянні з 29,4 % пацієнтів, які приймали інсулін гларгін (відношення шансів: 3,24; p < 0,001).
Частота випадків тяжкої гіпоглікемії на один пацієнто-рік експозиції (частка пацієнтів у відсотках) становила 0,00 (жодний з 278 пацієнтів) при застосуванні лікарського засобу Ксалтофай та 0,01 (1 з 279 пацієнтів) при застосуванні інсуліну гларгін. Частота випадків нічної гіпоглікемії була значно нижчою при застосуванні лікарського засобу Ксалтофай у порівнянні із застосуванням інсуліну гларгін (розраховане відношення залежно від лікування: 0,17; p < 0,001).
В ході другого дослідження, що було рандомізованим подвійно сліпим дослідженням тривалістю 26 тижнів за участю пацієнтів з незадовільним контролем при застосуванні базального інсуліну (20–40 одиниць) та монотерапії метформіном або його комбінації із сульфонілсечовиною/глінідами, вивчався перехід з базального інсуліну на лікарський засіб Ксалтофай або інсулін деглюдек. Застосування базального інсуліну та сульфонілсечовини/глінідів було припинено під час рандомізації. Максимально допустима доза становила 50 кроків дози лікарського засобу Ксалтофайта 50 одиниць для інсуліну деглюдек. У 48,7 % пацієнтів, які отримували Ксалтофай, було досягнуто цільовий рівень HbA1c < 7 % без підтверджених епізодів гіпоглікемії. Ця частка була значно більшою, ніж при застосуванні інсуліну деглюдек (15,6 %; відношення шансів: 5,57; p < 0,0001).
Частота випадків тяжкої гіпоглікемії на один пацієнто-рік експозиції (частка пацієнтів у відсотках) становила 0,01 (1 з 199 пацієнтів) при застосуванні лікарського засобу Ксалтофай та 0,00 (жоден зі 199 пацієнтів) при застосуванні інсуліну деглюдек. Частота випадків нічної гіпоглікемії була схожою при лікуванні лікарським засобом Ксалтофай та інсуліном деглюдек.
Таблиця 4. Результати через 26 тижнів. Перехід з терапії базальним інсуліном.
|
|
Перехід з терапії інсуліном гларгін (100 ОД/мл) |
Перехід з терапії базальним інсуліном [НПХ-інсулін (нейтральний протамін Хагедорна), інсулін детемір, інсулін гларгін] |
||
|
|
Ксалтофай |
Інсулін гларгін, без обмеження дози |
Ксалтофай |
Інсулін деглюдек, максимальна дозволена доза – 50 одиниць |
|
N |
278 |
279 |
199 |
199 |
|
HbA1c, % |
|
|
|
|
|
Початок → кінець дослідження |
8,4→6,6 |
8,2→7,1 |
8,7→6,9 |
8,8→8,0 |
|
Середня зміна |
˗1,81 |
₋1,13 |
₋1,90 |
₋0,89 |
|
Розрахована різниця |
|
₋0,59AB[₋0,74; ₋0,45] |
|
₋1,05AB[₋1,25; ₋0,84] |
|
Пацієнти (%), які досягли HbA1c < 7% |
|
|
|
|
|
Усі пацієнти |
71,6 |
47,0 |
60,3 |
23,1 |
|
Розрахований показник відношення шансів |
|
3,45B [2,36; 5,05] |
|
5,44B [3,42; 8,66] |
|
Пацієнти (%), які досягли HbA1c £ 6,5% |
|
|
|
|
|
Усі пацієнти |
55,4 |
30,8 |
45,2 |
13,1 |
|
Розрахований показник відношення шансів |
|
3,29B [2,27; 4,75] |
|
5,66B [3,37; 9,51] |
|
Частота випадків підтвердженої гіпоглікемії* на один пацієнто-рік експозиції (частка пацієнтів у %) |
2,23 (28,4%) |
| ||