Для поліпшення роботи сайту ми використовуємо файли cookie. Продовжуючи переглядати сайт, ви погоджуєтеся з цим.
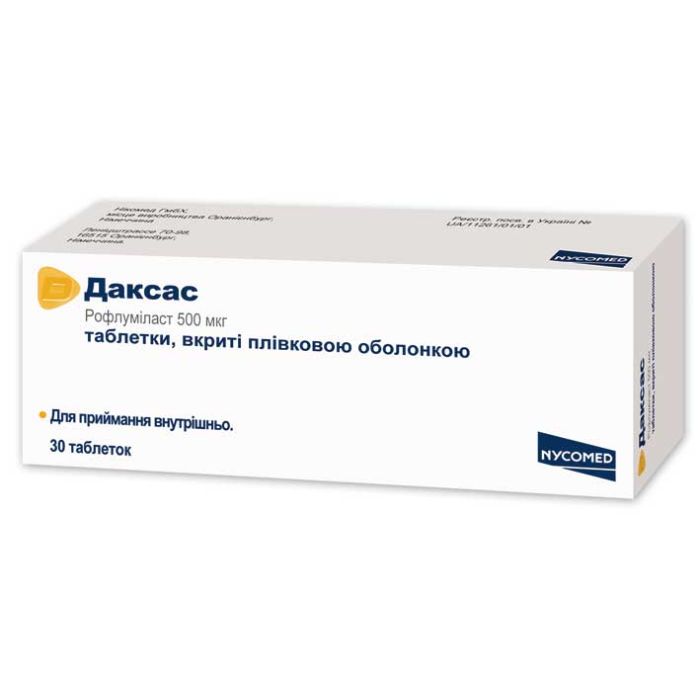
Даксас 500 мг таблетки №30
0,00 ₴
Nycomed (Австрія)
Арт.
200478
У список
Даксас 500 мг таблетки №30 Nycomed (Австрія)
Nycomed (Австрія)
-

 Значення "Можна" вказує на те, що вибраний препарат має мінімальний ризик для здоров'я дорослого населення і результат, очікуваний від вживання лікарського засобу, переважає над можливими ризиками. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Значення "Можна" вказує на те, що вибраний препарат має мінімальний ризик для здоров'я дорослого населення і результат, очікуваний від вживання лікарського засобу, переважає над можливими ризиками. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем. -


-

 Значення "Не можна" вказує на те, що вибраний препарат має максимальний ризик для здоров'я вагітних жінок і, відповідно, ризики від вживання даного лікарського препарату переважають над очікуваним результатом. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Значення "Не можна" вказує на те, що вибраний препарат має максимальний ризик для здоров'я вагітних жінок і, відповідно, ризики від вживання даного лікарського препарату переважають над очікуваним результатом. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем. -

 Значення "Не можна" вказує на те, що вибраний препарат має максимальний ризик для здоров'я годуючих жінок, і відповідно, ризики від вживання даного лікарського препарату переважають над очікуваним результатом. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Значення "Не можна" вказує на те, що вибраний препарат має максимальний ризик для здоров'я годуючих жінок, і відповідно, ризики від вживання даного лікарського препарату переважають над очікуваним результатом. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем. -

 Значення "З обережністю" вказує на те, що вибраний препарат може чинити підвищений негативний вплив на здоров'я алергіків, такі лікарські засоби рекомендується вживати, якщо очікуваний результат від застосування цього лікарського препарату переважає над всілякими ризиками. Щоб уникнути несприятливих наслідків, будь-який медикаментозний препарат слід вживати після консультації з провідним фахівцем.
Значення "З обережністю" вказує на те, що вибраний препарат може чинити підвищений негативний вплив на здоров'я алергіків, такі лікарські засоби рекомендується вживати, якщо очікуваний результат від застосування цього лікарського препарату переважає над всілякими ризиками. Щоб уникнути несприятливих наслідків, будь-який медикаментозний препарат слід вживати після консультації з провідним фахівцем. -

 Значення "Можна" вказує на те, що вибраний препарат має мінімальний ризик для здоров'я діабетиків і результат, очікуваний від вживання лікарського засобу, переважає над можливими ризиками. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Значення "Можна" вказує на те, що вибраний препарат має мінімальний ризик для здоров'я діабетиків і результат, очікуваний від вживання лікарського засобу, переважає над можливими ризиками. Щоб уникнути негативних наслідків, будь-який медикаментозний препарат слід застосовувати після консультації з лікарем.
Залишилися питання?
Ми раді допомогти
Характеристики товара
| Виробник | Nycomed (Австрія) |
|---|---|
| Форма товару | Таблетки |
| Тип кашлю | Від вологого кашлю |
| Країна виробництва | Австрія |
| Взаємодія з алкоголем | Немає даних |
| Бренд | Даксас |
| Умови відпуску | без рецепту |
| Призначення | Від кашлю |
| Температура зберiгання | не вище 25°C |
Інструкція

Оновлено: 08.07.2025
Перевірено
Інструкція
Даксас (Daxas) інструкція по застосуванню
Склад
діюча речовина: roflumilast
1 таблетка містить:
- 500 мкг рофлуміласту;
допоміжні речовини: лактозa, моногідрат; крохмаль кукурудзяний; повідон (К 90); магнію стеарат;
плівкова оболонка: гіпромелоза 2910; макрогол 4000; титану діоксид (Е 171); заліза оксид жовтий (Е 172).
Лікарська форма
Таблетки, вкриті плівковою оболонкою.
Основні фізико-хімічні властивості: таблетки жовтого кольору, D-подібної форми, вкриті плівковою оболонкою, з тисненням «D» з одного боку; на зламі з включеннями білого або майже білого кольору.
Фармакотерапевтична група
Засоби, що застосовують при обструктивних захворюваннях дихальних шляхів.Інші засоби для системного застосування при обструктивних захворюваннях дихальних шляхів.
Код АТХ R03D Х07.
Фармакологічні властивості
Фармакодинаміка. Механізм дії.Рофлуміласт – інгібітор фосфодіестерази 4 типу (ФДЕ4), дія якого спрямована на лікування системних і легеневих запальних процесів, пов’язаних із хронічними обструктивними захворюваннями легень (ХОЗЛ). Механізм дії препарату полягає в інгібуванні ФДЕ4 та дії на основний циклічний аденозинмонофосфат (цАМФ) – метаболізуючий фермент, що знаходиться в клітинах зони запалення і структурних клітинах, які є важливими у патогенезі ХОЗЛ. Дія рофлуміласту спрямована на ФД4ЕA, 4B і 4D, тип рецепторів з аналогічним потенціалом у наномолярному діапазоні. Афінність до типу ФДЕ4С у 5-10 разів нижча. Даний механізм дії і селективність також стосуютьсяN- оксиду рофлуміласту, котрий є основним активним метаболітом рофлуміласту.
Інгібування ФДЕ4 призводить до збільшення внутрішньоклітинного рівня основного цАМФ і послаблення зв’язаної з ХОЗЛ дисфункції лейкоцитів, клітин дихальних шляхів і гладком’язових клітин судин легень, ендотеліальних і епітеліальних клітин дихальних шляхів, а також фібробластів в експериментальних зразках. На основі стимуляцiіnї vitro людських нейтрофілів, моноцитів, макрофагів або лімфоцитів рофлуміласт та N-оксид рофлуміласту послаблюють вивільнення медіаторів запалення, таких як лейкотрієн В4, активні форми кисню, фактор некрозу пухлин α, інтерферон γ і гранзим В.
У пацієнтів з ХОЗЛ рофлуміласт знижував рівень нейтрофілів у мокротинні і, більше того, знижував надходження нейтрофілів і еозинофілів у дихальні шляхи у здорових добровольців.
Фармакокінетика. Рофлуміласт активно метаболізується в організмі людини з утворенням основного активного метаболіту – N-оксиду рофлуміласту. Оскільки і рофлуміласт,Nі - оксид рофлуміласту беруть участь в інгібуванні ФДЕi4n vivo, фармакокінетичні властивості базуються на загальному інгібуванні активності ФДЕ4 (тобто загальна експозиція рофлуміласту і N-оксиду рофлуміласту).
Абсорбція. Абсолютна біодоступність рофлуміласту після перорального прийому дози500 мкг становить близько 80 %. Максимальної плазмової концентрації (Сmax) рофлуміласт досягає через 1 годину (0,5-2 години) після його застосування натще, N-оксид рофлуміласту – через 8 годин (4-13 годин). Прийом їжі не впливає на загальну інгібуючу активність ФДЕ4, але затримує час досягнення максимальної концентрації t(max) рофлуміласту на 1 годину і знижує Сmax приблизно на 40 %. Однак прийом їжі не впливає на tmax і Сmax N-оксиду рофлуміласту.
Розподіл. Зв’язування з білками плазми крові рофлуміласту Nі -оксиду рофлуміласту становить приблизно 99 % і 97 % відповідно. Об’єм розподілу одноразової дози препарату – 500 мкг рофлуміласту – становить близько 2,9 л/кг маси тіла.
Метаболізм. Рофлуміласт активно метаболізується у реакціях фази І (цитохром Р450) і фази ІІ (зв’язування). Метаболіт N-оксид рофлуміласту є основним метаболітом у плазмі крові людини. Площа під кривою «концентрація-час» A( UC) метаболітуN-оксиду рофлуміластув середньому у 10 разів більша, ніжAUC рофлуміласту. Таким чином, N- оксид рофлуміласту є основним фактором інгібування активності ФДЕ4in vivo.
Згідно з дослідженнями in vitro і дослідженнями клінічної взаємодії можна вважати, що метаболізм N-оксиду рофлуміласту здійснюється за рахуноCк YP1A2 і 3А4. На основі подальших результатівin vitro з використанням печінкових мікросом людини показано, що терапевтичні концентрації в плазмі крові рофлуміласту і N-оксиду рофлуміласту не інгібуютьCYP1A2, 2А6, 2В6, 2С8, 2С9, 2С19, 2D6, 2Е1, 3А4/5, 4А9/11, тому вірогідність відповідної взаємодії із препаратами, що метаболізуються ферментами системи цитохромів Р450, низька. Також дослідженняin vitro показали, що рофлуміласт не призводить до індукціїCYP1A2, 2А6, 2С9, 2С19, 3А4/5 та спричиняє слабку індукціюCYP2В6.
Виведення. Плазмовий кліренс після короткочасної внутрішньовенної інфузії рофлуміласту становить 9,6 л/год. При пероральному прийомі період напіввиведення рофлуміласту і N- оксиду рофлуміласту становить приблизно 17 і 30 годин відповідно. Стабільна концентрація для рофлуміласту досягається через 4 дні, для N-оксиду рофлуміласту – через 6 днів після прийому одноразової дози на добу. Після внутрішньовенного або перорального застосування рофлуміласту з радіоактивною міткою близько 20 % радіоактивності визначалось у калі і 70 % – у сечі у вигляді неактивних метаболітів.
Лінійність/нелінійність. Фармакокінетика рофлуміласту і N-оксиду рофлуміласту є лінійною у дозуванні в діапазоні від 250 мкг до 1000 мкг.
Особливі групи пацієнтів. Загальна інгібуюча активність ФДЕ4 зростає серед пацієнтів літнього віку, жінок і осіб, що не належать до європеоїдної раси. У осіб, які курятзьа,гальна інгібуюча активність ФДЕ4 трохи знижується. Але ці зміни не є клінічно значущими. Ці категорії пацієнтів не потребують коригування дози. До окремої категорії пацієнтів можна віднести жінок негроїдної раси, які не курять, у яких застосування препарату може призвести до підвищення ризику побічних явищ та стійкої непереносимості. В даному випадку необхідно переглянути лікування препаратом Даксас (див. розділ «Особливості застосування»).
Ниркова недостатність. Загальна інгібуюча активність ФДЕ4 знижується на 9 % у пацієнтів із тяжкою нирковою недостатністю (кліренс креатиніну становить 10-30 мл/хв). Дозування не потребує коригування.
Печінкова недостатність. Фармакокінетика препарату Даксас, 250 мкг один раз на добу, була досліджена у пацієнтів із печінковою недостатністю легкого та середнього ступеня (за класифікацієюЧайлд-П’ю, ступінь А і В). Загальнаінгібуюча активність ФДЕ4 збільшилася приблизно на 20 % у пацієнтів, що мають ступінь Аза шкалою Чайлд-П’ю, і на 90 % – у пацієнтів, що мають ступінь В за шкалою Чайлд-П’ю. Дослідження вказують на пропорційність доз 250 та 500 мкг препарату Даксас у пацієнтів ізпечінковою недостатністю легкого та середнього ступеня.Пацієнти, які мають ступінь А за шкалою Чайлд-П’ю, повинні з обережністю застосовувати препарат (див. розділ «Спосіб застосування і дози»).Пацієнтам зі ступенями В і С за шкалоюЧайлд-П’ю не слід застосовувати препарат Даксас (див. розділ «Протипоказання»).
Клінічні характеристики.
Показання
Для підтримуючої терапії при хронічних обструктивних захворюваннях легень (ХОЗЛ) тяжкого перебігу (об’єм форсованого видиху за першу секунду (ОФ1В) при застосуванні бронходилататорів менше 50 % від належних), що пов’язані з хронічним бронхітом у дорослих та частими загостреннями ХОЗЛ в анамнезі, як додатковий засіб при бронходилатуючій терапії.
Протипоказання Даксасу
Підвищена чутливість до рофлуміласту або до інших компонентів препарату. Печінкова недостатність середнього або тяжкого ступеня(ступінь В або С за шкалою Чайлд-П’ю).
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Клінічні дослідження щодо взаємодії лікарських засобів проводили тільки за участю дорослих пацієнтів. Основний етап у метаболізмі рофлуміласту –N-окиснення рофлуміласту до N-оксиду рофлуміласту за допомогою цитохромCYP3A4 і CYP1A2.
Рофлуміласт і N-оксид рофлуміласту інгібують ФДЕ4, тому після внутрішнього прийому рофлуміласту загальна інгібуюча активність ФДЕ4 являє собою сумарну дію рофлуміласту і N-оксиду рофлуміласту.
Дослідження взаємодії з інгібітором цитохрому CYP1A2/3A4 еноксацином таінгібіторами цитохрому CYP1A2/2C19/3A4 циметидином і флувоксаміном показали збільшення загальної інгібуючої активності ФДЕ4 на 25 %, 47 % і59 % відповідно. Пробна доза флувоксаміну становила 50 мг. Сумісне застосування препарату Даксас з цими активними речовинами може спричинити збільшення ризику побічних явищ та стійку непереносимість. У цьому випадку необхідно переглянути лікування препаратом Даксас (див. розділ «Особливості застосування»).
Прийом індуктора цитохрому Р450 рифампіцину спричинив зниження загальної інгібуючої активності ФДЕ4 приблизно на 60 %. Тому застосування сильнодіючих індукторів цитохрому Р450 (наприклад, фенобарбіталу, карбамазепіну, фенітоїну) може призвести до зниження терапевтичного ефекту рофлуміласту. Таким чином, лікування препаратом Даксас не рекомендується пацієнтам, які застосовують сильнодіючі індуктори цитохрому P450.
Клінічні дослідження взаємодії з інгібіторами цитохрому CYP3A4 еритроміцином і кетоконазолом показали збільшення загальної інгібуючої активності ФДЕ4 на 9 %. Одночасний прийом з теофіліном показав збільшення загальної інгібуючої активності ФДЕ4 на 8 % (див. розділ «Особливості застосування»). При дослідженнях взаємодії з пероральними контрацептивами, що містять гестоден, етинілестрадіол, загальна інгібуюча активність ФДЕ4 збільшилася на 17 %. Пацієнтам, які застосовують ці активні речовини, корекція режиму дозування не потрібна.
Не спостерігалося взаємодії препарату із сальбутамолом, формотеролом, будесонідом, які застосовувались інгаляційно, та пероральними формами монтелукасту, дигоксину, варфарину, силденафілу та мідазоламу.
Одночасний прийом з антацидами (комбінація алюмінію гідроксиду та магнію гідроксиду) не змінював показники всмоктування або фармакокінетики рофлуміласту або його N- оксиду.
Особливості застосування препарату
Пацієнтів потрібно проінформувати про можливі ризики та запобіжні заходи щодо застосування препарату Даксас.
Препарат для купірування симптомів. Препарат Даксас не призначається для полегшення бронхоспазму гострого характеру.
Зниження маси тіла. Під час досліджень протягом року у пацієнтів, які застосовували препарат Даксас, частіше спостерігалося зниження маси тіла порівняно із пацієнтами плацебо-групи. Після припинення прийому препарату Даксас у більшості пацієнтів маса тіла відновлювалася протягом 3 місяців.
Пацієнтам зі зниженою масою тіла слід регулярно перевіряти її як самостійно, так і при кожному візиті до лікаря. У разі різко вираженого зниження маси тіла невідомої етіології необхідно припинити прийом препарату Даксас і відстежувати динаміку маси тіла.
Особливі клінічні умови. Внаслідок відсутності достатнього досвіду не слід починати лікування препаратом Даксас або припинити розпочате лікування у пацієнтів із тяжкими імунологічними захворюваннями (такими як, ВІЛ-інфекція, розсіяний склероз, системний червоний вовчак, прогресуюча мультифокальна лейкоенцефалопатія), тяжкими формами гострих інфекційних захворювань, захворюваннями на рак (за винятком базально- клітинної карциноми) або у пацієнтів, які лікувались імунодепресивними препаратами (наприклад, метотрексатом, азатіоприном, інфліксимабом, етанерцептом або отримували довготривалу терапію пероральними кортикостероїдами, за винятком системних кортикостероїдів короткочасної дії).Досвід застосування препарату хворим з латентними інфекціями, такими як туберкульоз, вірусний гепатит, герпесвірусна інфекція, оперізувальний лишай, є обмеженим.
Дослідження за участю пацієнтів із застійною серцевою недостатністю не проводились (NYHA 3-4 класу), тому лікування пацієнтів даної групи препаратом Даксас не рекомендовано.
Психічні розлади. Застосування препарату Даксас пов’язано із підвищеним ризиком психічних розладів, таких як безсоння, неспокій, підвищена збудженість і депресія. У перші тижні лікування препаратом у пацієнтів з депресією або без такої в анамнезі зустрічались рідкі випадки суїцидальних думок і поведінки, в тому числі самогубство (див. розділ «Побічні реакції»). Тому необхідно ретельно оцінювати користь/ризик від терапії препаратом Даксас, особливо якщо пацієнт повідомляє про попередні або існуючі психічні розлади, а також якщо пацієнт застосовує інші препарати, що можуть викликати психічні розлади. Даксас не рекомендується застосовувати пацієнтам з депресією, асоційованою із суїцидальними думками або поведінкою, в анамнезі. Необхідно проінформувати пацієнта та особу, яка здійснює догляд за хворим, повідомляти лікаря у разі виникнення змін у поведінці або настрою, або у разі будь-яких суїцидальних думок. Якщо пацієнти страждають від нових симптомів або погіршення психічних розладів, суїцидальних думок або суїцидальних спроб, рекомендується припинити лікування препаратом Даксас.
Стійка непереносимість. Небажані явища, такі як діарея, нудота, біль у животі і головний біль, зазвичай спостерігаються у перші тижні лікування і зникаютьпід час подальшого лікування. Лікування препаратом Даксас необхідно переглянути у випадку стійкої непереносимості. Це може стосуватися особливих груп населення з підвищеним ризиком: жінок негроїдної раси, які не курять, або пацієнтів, які застосовують супутню терапію інгібіторами цитохромуCYP1A2/2C19/3A4 – флувоксаміном і циметидином, або інгібітором цитохрому CYP1A2/3A4 – еноксацином (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Теофілін. Супутнє застосування теофіліну як підтримуючої терапії не рекомендовано, оскільки немає достатніх клінічних даних щодо сумісного застосування з препаратом Даксас.
Лактоза. Препарат Даксас, таблетки, вкриті плівковою оболонкою, містить лактозу.
Пацієнтам, які мають рідкісну спадкову непереносимість галактози, лактазну недостатність або порушення всмоктування глюкози-галактози, не слід застосовувати препарат.
Застосування у період вагітності або годування груддю
Жінки репродуктивного віку. Жінкам репродуктивного віку рекомендується застосовувати ефективні методи контрацепції під час лікування. Застосування препарату Даксас не рекомендується жінкам репродуктивного віку, які не застосовують контрацепцію.
Вагітність. Клінічні дані щодо застосування препарату вагітними жінками обмежен, ітому Даксас не рекомендується застосовувати під час вагітності.Дослідження на тваринах показали репродуктивну токсичність.
Період годування груддю. Дослідження на тваринах показали, що рофлуміласт і його метаболіти проникають у грудне молоко. Не можна виключити ризик потрапляння препарату під час годування груддю до дитини, тому Даксас не слід застосовувати у цей період.
Фертильність. При дослідженнях сперматогенезу людини рофлуміласт у рекомендованому дозуванні 500 мкг не впливав на параметри сперми або статеві гормони протягом тримісячного лікування і протягом 3-х місяців після припинення лікування.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
В індивідуальних випадках деякі побічні реакції з боку центральної нервової системи можуть впливати на здатність керувати автотранспортом або працювати з іншими механізмами.
Спосіб застосування та дози Даксас
Препарат Даксас, таблетки, вкриті плівковою оболонкою, застосовують перорально, не розжовуючи, запиваючи водою, в один і той же час, незалежно від прийому їжі.
Рекомендована доза для дорослих становить 1 таблетку (500 мкг рофлуміласту) 1 раз на добу.
Для досягнення терапевтичного ефекту необхідно застосовувати препарат протягом декількох тижнів.
Пацієнти літнього віку не потребують коригування дози.
Пацієнти з нирковою недостатністю не потребують коригування дози.
Пацієнти з печінковою недостатністю легкого ступеня (ступінь А за шкалоюЧайлд-П’ю) повинні з обережністю застосовувати препарат, оскільки недостатньо даних для коригування дози. Пацієнтам із середнім або тяжким ступенем печінкової недостатност(і ступінь В або С за шкалою Чайлд-П’ю) не застосовують препарат (див. розділ «Протипоказання»).
Діти
Препарат не застосовують дітям (віком до 18 років).
Передозування
Симптоми. Під час І фази досліджень після одноразового перорального прийому доз2500 мкг і 5000 мкг рофлуміласту (в 10 разів більше рекомендованої дози) часто спостерігались такі симптоми: головний біль, порушення роботи травного тракту, запаморочення, прискорене серцебиття, переднепритомний стан, вологість рук, артеріальна гіпотензія.
Лікування. У разі передозування проводять відповідну симптоматичну терапію. Оскільки рофлуміласт значною мірою зв’язується білками, гемодіаліз не є ефективним. Ефективність перитонеального діалізу невідома.
Побічні реакції Даксасу
Під час проведення клінічних досліджень приблизно у 16 % пацієнтів з ХОЗЛ виникали небажані побічні реакції після прийому рофлуміласту ( у плацебо-групі – у 5 % пацієнтів). Найчастіші: діарея (5,9 %), зменшення маси тіла (3,4 %), нудота (2,9 %), біль у живот(і1,9 %), головний біль (1,7 %). Більшість цих побічних реакцій мали легкий або помірний характер, виникали протягом перших тижнів лікування і зникали при подальшому лікуванні.
Небажані ефекти за частотою виникнення класифікують за такими категоріями: дуже часто (> 1/10); часто (> 1/100, < 1/10); нечасто (> 1/1000, < 1/100); рідко (> 1/10000, < 1/1000); дуже рідко (< 1/10000); невідомо (частота не визначена за доступними даними).
З боку імунної системи.
- Нечасто: гіперчутливість.
- Рідко: ангіоедема.
З боку ендокринної системи.
- Рідко: гінекомастія.
З боку обміну речовин.
- Часто: зменшення маси тіла, зниження апетиту. Психічні розлади.
- Часто: безсоння.
- Нечасто: неспокій.
- Рідко: суїцидальні думки та суїцидальна поведінка*, депресія, підвищена збудженість, напад паніки.
З боку нервової системи.
- Часто: головний біль.
- Нечасто: тремор, вертиго, запаморочення.
- Рідко: дисгевзія.
З боку серцево-судинної системи.
- Нечасто: пальпітація.
З боку дихальної системи.
- Рідко: інфекції дихальних шляхів (за винятком пневмонії).
З боку травного тракту.
- Часто: діарея, нудота, біль у животі.
- Нечасто: гастрит, блювання, гастроезофагеальна рефлюксна хвороба, диспепсія.
- Рідко: кров’янисті випорожнення, запор.
З боку гепатобіліарної системи.
- Рідко: підвищення рівня гамма-глутамілтрансферази, аспартатамінотрансферази (АСТ).
З боку шкіри та підшкірної клітковини.
- Нечасто: висип ання. Рідко: кропив’янка.
З боку опорно-рухового апарату та сполучної тканини.
- Нечасто: м’язові спазми і слабкість, міалгія, біль у спині.
- Рідко: збільшення рівня креатинфосфокінази (КФК) крові.
Порушення загального характеру.
- Нечасто: нездужання, астенія, втома.
*Під час дослідження та післяреєстраційного застосування є рідкі повідомлення про випадки суїцидальних думок та суїцидальної поведінки, у тому числі самогубство. Необхідно проінформувати пацієнта та особу, яка здійснює догляд за хворим, повідомляти лікаря у разі виникнення суїцидальних думок (див. розділ «Особливості застосування»).
Термін придатності
3 роки.
Умови зберігання
Не потребує особливих умов зберігання.Зберігати в недоступному для дітей місці!
Упаковка
По 10 таблеток у блістері; по 3 або по 9 блістерів у картонній коробці.
Категорія відпуску з аптеки
За рецептом.
Відгуки користувачів
Цей продукт ще не має відгуків.
Залишити відгук
Зверніть увагу
Інформація/інструкція до препарату носить ознайомчий характер і призначена виключно для інформаційних цілей.