Для поліпшення роботи сайту ми використовуємо файли cookie. Продовжуючи переглядати сайт, ви погоджуєтеся з цим.
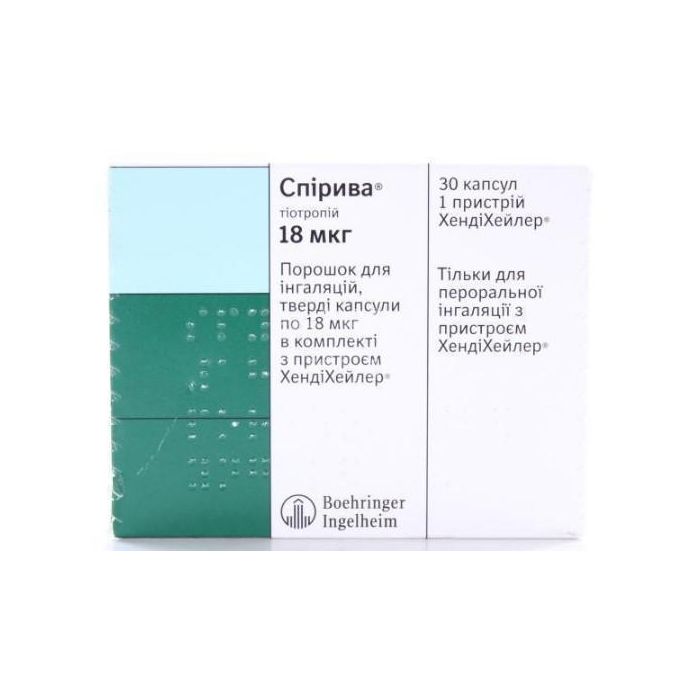
Спірива 18 мкг порошок для ін'єкцій капсули №30 + Хенді Хейлер
0,00 ₴
Boehringer Ingelheim (Німеччина)

Арт.
123043
У список
Спірива 18 мкг порошок для ін'єкцій капсули №30 + Хенді Хейлер
Boehringer Ingelheim (Німеччина)
Залишилися питання?
Ми раді допомогти
Характеристики товара
| Виробник | Boehringer Ingelheim (Німеччина) |
|---|---|
| Форма товару | Порошок |
| Штрих-код | 9006968002491 |
| Бренд | Спірива |
| Умови відпуску | без рецепту |
| Призначення | Від кашлю |
| Температура зберiгання | спеціальних умов зберігання немає |
Інструкція надана держ. реєстром мед. препаратів України

Перевірено: Громадська Яна

Перевірено: Кортунова Юлія
Оновлено: 04.05.2024
Провірено
Інструкція
ІНСТРУКЦІЯ
для медичного застосування препарату
СпіриваÒ
(SPIRIVAÒ)
- Склад
- Лікарська форма
- Фармакотерапевтична група
- Клінічні характеристики
- Показання
- Протипоказання
- Спосіб застосування та дози
- Побічні реакції
- Передозування
- Застосування у період вагітності або годування груддю
- Діти
- Особливості застосування
- Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами
- Взаємодія з іншими лікарськими засобами та інші види взаємодій
- Фармакологічні властивості
- Фармацевтичні характеристики
- Основні фізикохімічні властивості
- Ермін придатності
- Умови зберігання
- Упаковка
- Категорія відпуску
- Виробник
- Місцезнаходження
Склад:
діюча речовина: тіотропію бромід;
1 капсула містить тіотропію броміду моногідрату 22 5 мкг що відповідає тіотропію 18 мкг;
допоміжні речовини: лактози моногідрат мікронізований лактози моногідрат 200 М.
Лікарська форма. Порошок для інгаляцій тверді капсули.
Фармакотерапевтична група. Протиастматичний засіб що застосовується інгаляційно. Код АТС R03B B04.
Клінічні характеристики.
Показання.
Підтримуюча бронхолітична терапія для полегшення симптомів при хронічному обструктивному захворюванні легень (ХОЗЛ).
Протипоказання.
Порошок для інгаляцій Спірива протипоказаний пацієнтам з відомою гіперчутливістю до тіотропію броміду атропіну або його похідних (до іпратропію або окситропію) або до інших компонентів препарату.
Спосіб застосування та дози.
Лікарський засіб призначений лише для застосування інгаляційно.
Рекомендована доза СПІРИВИ складається з інгаляції вмісту однієї капсули 1 раз на добу за допомогою інгаляційного пристрою ХендіХейлер. Інгаляцію слід робити в один і той же час доби.
Рекомендовану дозу не слід перевищувати.
Капсули не призначені для орального застосування капсули СПІРИВА не можна ковтати.
Препарат слід застосовувати лише за допомогою інгаляційного пристрою ХЕНДІХЕЙЛЕР.
Особливі групи
Пацієнтам літнього віку застосовувати СПІРИВУ лише у рекомендованому лікарем дозуванні.
Пацієнтам з нирковою недостатністю слід застосовувати СПІРИВУ згідно з рекомендованою лікарем дозою. Інформація про застосування СПІРИВИ пацієнтам з нирковою недостатністю від помірної до тяжкої (кліренс креатиніну ≤ 50 мл/хв) наведена в розділах «Особливості застосування» та «Фармакокінетика».
Пацієнтам з печінковою недостатністю можна застосовувати СПІРИВУ згідно з рекомендованою лікарем дозою (див. розділ «Фармакокінетика»).
Інструкція для застосування.
Для забезпечення належного застосування препарату необхідно проінформувати пацієнта як використовувати інгалятор.
При застосуванні препарату СПІРИВА слід дотримуватися рекомендацій лікаря.
Інгаляційний пристрій ХендіХейлер був розроблений спеціально для капсул СПІРИВИ. Його не слід використовувати з іншими медикаментами.
Можна застосовувати Ваш ХендіХейлер протягом одного року використовуючи його за призначенням.
|
|
1. Щоб відкрити пилозахисний ковпачок натиснути на кнопку для розпилення до упору та відпустити. |
|
2. Відкрити пилозахисний ковпачок піднявши його вгору. Потім відкрити мундштук піднявши його вгору. |
|
3. Вилучити капсулу СПІРИВИ з блістера (безпосередньо перед застосуванням) та розмістити її на платформі з центральною камерою як показано на малюнку. Немає значення якою стороною помістити капсулу в камеру (5). |
|
4. Закрити мундштук щільно до клацання залишити пилозахисний ковпачок відкритим. |
|
5. Тримати ХендіХейлер мундштуком угору і натиснути кнопку для розпилення до упору один раз і відпустити. Це робить отвори в оболонці капсули та дає змогу лікам вивільнитися при вдиханні. |
|
6. Повністю видихнути. Важливо: не видихати у мундштук у будь-якому разі. |
|
7. Вдихати поки легені не наповняться; потім якомога довше затримати дихання і в той же самий час вийняти мундштук із рота. Поновити дихання. Повторити дії зазначені на малюнках 6 і 7 один раз – це повністю випорожнить капсулу. |
|
8. Відкрити мундштук знову. Витягти використану капсулу і викинути. Закрити мундштук і пилозахисний ковпачок для зберігання пристрою ХЕНДІХЕЙЛЕР. |
|
Очистка пристрою ХЕНДІХЕЙЛЕР Чистити пристрій ХендіХейлер один раз на місяць. Відкрити пилозахисний ковпачок і мундштук. Потім відкрити основу піднімаючи кнопку для розпилення. Промити весь інгалятор теплою водою для видалення порошку. Ретельно висушити пристрій ХендіХейлер промокаючи залишок води паперовою серветкою і просушуючи на повітрі залишити при цьому пилозахисний ковпачок мундштук і основу відкритими. Просушування на повітрі займає 24 години отже очищення треба розпочинати одразу після використання щоб пристрій був готовий до наступного застосування. При необхідності мундштук можна очистити зовні за допомогою вологої але не мокрої тканини. |
|
Розкриття блістера А. Відділити смуги блістера розірвавши уздовж перфорації. |
|
В. Розкрити (безпосередньо перед використанням) до напису «СТОП». Якщо випадково була відкрита ще одна капсула то її слід викинути. |
|
|
|
Капсули СПІРИВА містять лише невелику кількість порошку таким чином капсула наповнена лише частково.
Побічні реакції.
Багато з перерахованих небажаних ефектів можна віднести до антихолінергічних властивостей СПІРИВи.
Побічні реакції на препарат було визначено за даними отриманими з клінічних випробувань і спонтанних повідомлень протягом післяреєстраційного періоду. База даних клінічних досліджень включає 9 647 пацієнтів які застосовували тіотропій у 28 плацебо контрольованих клінічних випробуваннях з періодом лікування від 4 тижнів до 4 років.
Частота виникнення побічних ракцій відповідно до Конвенції MedDRA:
дуже часто (≥ 1/10);
часто (≥ 1/100 < 1/10);
нечасто (≥ 1/1000 < 1/100);
поодинокі (≥ 1/10000 < 1/1000);
рідкісні (<1/10000);
невідомо (не можна визначити за наявними даними).
З боку обміну речовин:
невідомо – зневоднення.
З боку центральної нервової системи:
нечасто – запаморочення головний біль порушення смакових відчуттів;
поодинокі – безсоння.
З боку органів зору:
нечасто – нечіткість зору;
поодинокі – глаукома підвищення внутрішньоочного тиску.
З боку серцево-судинної системи:
нечасто – фібриляція передсердь;
поодинокі – суправентрикулярна тахікардія тахікардія відчуття серцебиття.
З боку дихальної системи органів грудної клітки та середостіння:
нечасто – кашель дисфонія фарингіт;
поодинокі – бронхоспазм носові кровотечі ларингіт синусит.
З боку шлунково-кишкового тракту:
часто – сухість у роті;
нечасто – запор гастроезофагеальна рефлюксна хвороба кандидоз ротової порожнини і глотки;
поодинокі – непрохідність кишечнику що включає паралітичну непрохідність кишечнику; дисфагія гінгівіт глосит стоматит нудота;
невідомо – карієс зубів.
З боку імунної системи шкіри та підшкірної клітковини:
нечасто – висип;
поодинокі – ангіоневротичний набряк гіперчутливість (включаючи алергічні реакції негайного типу) свербіж кропив'янка;
невідомо – сухість шкіри інфекції шкіри та утворення виразок анафілактичні реакції.
З боку опорно-рухової системи та сполучної тканини:
невідомо – набряк суглобів.
З боку сечовидільної системи:
нечасто – затримка сечі дизурія;
поодинокі – інфекція сечових шляхів.
Опис окремих побічних реакцій
У контрольованих клінічних дослідженнях зазвичай спостерігалися наступні антихолінергічні побічні реакції такі як сухість у роті які відзначалися приблизно в 4 % пацієнтів.
У 28 клінічних випробуваннях сухість у роті призвела до припинення прийому препату у 18 з 9647 пацієнтів (0 2 %).
Серйозні побічні ефекти включають глаукому запор непрохідність кишечнику що включає паралітичну непрохідність кишечнику та затримку сечі.
Інші особливі групи населення
Кількість антихолінергічних ефектів може збільшитися з віком.
Передозування.
Високі дози Спіриви можуть спричинити антихолінергічні симптоми.
Проте системні антихолінергічні побічні ефекти були відсутні у здорових волонтерів після разової дози аж до 340 мкг тіотропію броміду.
Жодних значних побічних реакцій крім сухості в роті не спостерігалося після 7 днів прийому тіотропію броміду до 170 мкг у здорових добровольців.
У дослідженнях багаторазового дозування у пацієнтів із ХОЗЛ застосування максимальної добової дози 43 мкг тіотропію броміду протягом 4 тижнів не спричинило значних побічних реакцій.
Гостра інтоксикація при пероральному застосуванні капсул тіотропію малоймовірна через низьку пероральну біодоступність.
Застосування у період вагітності або годування груддю.
Вагітність. Дані щодо застосування тіотропію вагітним жінкам дуже обмежені. Доклінічні дослідження не виявили прямого або опосередкованого шкідливого впливу що стосується репродуктивної токсичності при клінічно значущих дозах. Як запобіжний захід слід уникати застосування СПІРИВИ протягом періоду вагітності.
Годування груддю. Невідомо чи тіотропію бромід проникає у грудне молоко. Застосування препарату у період годування груддю не рекомендовано.
Тіотропію бромід є сполукою тривалої дії. Рішення про те чи продовжувати/припиняти годування груддю або продовжувати/припиняти застосування СПІРИВИ слід приймати з урахуванням оцінки переваги грудного годування для дитини і користі від терапії для жінки.
Діти.
Препарат не призначений для застосування дітям.
Особливості застосування.
СПІРИВА є бронходилататором який призначають 1 раз на добу для підтримуючої терапії і не призначений для початкового лікування гострих нападів бронхоспазму.
Після застосування СПІРИВИ можуть виникнути реакції гіперчутливості негайного типу.
Як і інші антихолінергічні препарати СПІРИВУ слід застосовувати з обережністю пацієнтам із закритокутовою глаукомою гіперплазією передміхурової залози або обструкцією шийки сечового міхура (див. розділ «Побічні реакції»).
Інгаляційні препарати можуть спричиняти інгаляційно-індукований бронхоспазм.
Препарат слід використовувати з обережністю наступним пацієнтам: які нещодавно перенесли інфаркт міокарда ( <6 місяців); з будь-якою нестійкою або небезпечною для життя аритмією або аритмією що вимагала втручання або зміни терапії в минулому році; при госпіталізації з серцевою недостатністю (NYHA класу III або IV) протягом останнього року. Ці пацієнти були виключені з клінічних випробувань. За цих умов антихолінергічний ефект може їм зашкодити.
Оскільки концентрація у плазмі крові тіотропію броміду зростає у пацієнтів з нирковою недостатністю від помірної до тяжкої (кліренс креатиніну <£ 50 мл/хв) СПІРИВУ слід застосовувати тільки якщо очікувана користь перевищує потенційний ризик. Дані щодо тривалого застосування СПІРИВИ пацієнтам з нирковою недостатністю відсутні (див. розділ «Фармакокінетика»).
Пацієнти повинні уникати потрапляння порошку в очі. Це може призвести до погіршення закритокутової глаукоми болю або дискомфорту в очах тимчасової нечіткості зору відчуття появи ореолу або кольорових плям перед очима у комбінації з почервонінням ока у вигляді гіперемії кон’юнктиви або рогівки.
При появі перелічених симптомів у будь-якій комбінації слід не гаючи часу звернутися за спеціалізованою медичною допомогою.
Сухість у роті яка спостерігається при антихолінергічній терапії може в перспективі бути пов'язана з карієсом.
СПІРИВОЮ не слід користуватися більше одного разу на день.
Препарат містить 5 5 мг лактози моногідрату в одній капсулі.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Дослідження впливу на здатність керувати автомобілем або механічними пристроями не проводилися. Поява запаморочення або нечіткості зору може вплинути на здатність керувати автомобілем або механічними пристроями.
Незважаючи на те що формальні дослідження взаємодії з іншими лікарськими засобами не проводилися тіотропію бромід застосовували сумісно з іншими препаратами (симпатоміметичні бронходилататори метилксантини пероральні та інгаляційні стероїди що застосовують у лікуванні ХОЗЛ) без клінічних доказів щодо взаємодії з іншими лікарськими засобами.
Не було встановлено що використання агоністів бета-адренорецепторів тривалої дії або інгаляційних кортикостероїдів змінює експозицію тіотропію.
Однак призначення Спіриви у поєднанні з антихолінергічними лікарськими засобами не досліджувалося і отже не рекомендується для застосування.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії. Тіотропій є специфічним антихолінергічним агентом тривалої дії. Тіотропій має подібну спорідненість до всіх підтипів мускаринових рецепторів (від М1 до М5). У дихальних шляхах інгібіція М3-рецепторів спричиняє розслаблення гладкої мускулатури. У доклінічних дослідженнях in vitro та in vivo бронхопротективний ефект був дозозалежний та тривав більше 24 годин.
Тривалість ефекту зумовлена дуже повільним вивільненням із М3-рецепторів; період напіврозпаду тіотропію значно довший ніж у іпратропію. Як N-четвертинний антихолінергік тіотропій є місцево (бронхо-) селективним при інгаляційному застосуванні він демонструє прийнятний терапевтичний діапазон до виявлення системних антихолінергічних ефектів. Дисоціація із M2-рецепторів є швидшою ніж M3 у функціональних дослідженнях in vitro. М3 – більш прийнятний (кінетично контрольований) рецептор підтипу селективності ніж М2. Висока активність та повільна дисоціація з рецепторів клінічно корелювали зі значною та тривалою бронходилатацією у пацієнтів із хронічними обструктивними захворюваннями легень (ХОЗЛ).
Фармакодинамічні ефекти. Бронходилатація після інгаляції тіотропію у першу чергу є місцевим ефектом на дихальні шляхи що не є системним.
При застосуванні Спіриви один раз на день відзначалося значне покращання функції легень (збільшення об'єму форсованого видиху за першу секунду (ОФВ1) та форсованої життєвої ємності легень) протягом 30 хв після першої дози ефект тривав 24 години. Фармакодинамічний стабільний стан досягається протягом одного тижня. У більшості пацієнтів бронходилатація виникає на 3-й день.
Згідно зі щоденним вимірюванням Спірива значно покращує ранкову та вечірню максимальну швидкість видиху.
Покращання функції легень зберігається без ознак толерантності.
Бронходилатація триває протягом 24-годинного інтервалу дозування порівняно з плацебо. При цьому не враховувалося призначали СпіривУ вранці чи увечері.
Спірива значно зменшує задишку; покращання стану утримувалося протягом усього періоду лікування.
Спірива значно зменшує кількість загострень ХОЗЛ та припиняє виникнення першого загострення.
Спірива значно покращує якість життя що стосується здоров’я; покращання утримувалося протягом всього періоду лікування.
Спірива значно скорочує кількість госпіталізованих пацієнтів із загостреннями ХОЗЛ та затримує час першої госпіталізації.
У двох дослідженнях СПІРИВА значно покращила толерантність до фізичного навантаження обмеженого симптомами захворювання на 19 7 % та 28 3 % .
У дослідженні застосування СПІРИВИ по 18 мкг та 54 мкг (тричі по 18 мкг) протягом 12 днів неспричинило подовження QT-інтервалу за показниками електрокардіограми.
У чотирирічному дослідженні за участю 5 993 пацієнтів СПІРИВА підтримувала покращання показника ОФВ1 протягом усього періоду що проте не змінювало загальнорічний показник зниження ОФВ1.
Протягом лікування на 16 % зменшувався ризик летальності. Загальна частота летальних випадків складала 4 79 на 100 пацієнто-років у групі плацебо порівняно з 4 10 на 100 пацієнто-років у групі тіотропію (співвідношення ризиків (тіотропій/плацебо) = 0 84 95 % CI = 0 73; 0 97). Лікування тіотропієм зменшувало ризик дихальної недостатності на 19 % (2 09 порівняно з 1 68 випадків на пацієнто-років відносний ризик (тіотропій/плацебо) = 0 81 95 % CI = 0 65; 1 00).
Фармакокінетика. Тіотропій є четвертинною амонієвою сполукою що помірно розчиняється у воді. Тіотропій застосовують у вигляді сухого порошку для інгаляцій. Як правило при інгаляційному способі застосування більша частина дози що вивільняється осідає у шлунково-кишковому тракті та в меншій кількості – у легенях.
Абсорбція. Після інгаляції сухого порошку абсолютна біодоступність становить 19 5 % що є ознакою високої біодоступності фракції яка досягає легень. Абсолютна біодоступність розчину тіотропію для перорального застосування становить 2-3 %. Максимальна концентрація тіотропію у плазмі крові спостерігається через 5-7 хв після інгаляції.
При стабільному стані максимальний рівень тіотропію у плазмі крові пацієнтів з ХОЗЛ становив 12 9 пг/мл і швидко знижується багатостадійним чином. Нижній рівень концентрації тіотропію у плазмі крові при стабільному стані становить 1 71 пг/мл. Системний вплив після інгаляції тіотропію через пристрої ХЕНДІХЕЙЛЕР був схожий на вплив після інгаляції тіотропію через інгалятор РЕСПІМАТ.
Розподіл. 72 % препарату зв’язується з білками плазми крові. Об’єм розподілу становить 32 л/кг. Локальна концентрація у легенях невідома але виходячи зі способу застосування припускається висока концентрація в легенях. У дослідженнях на тваринах доведено що тіотропій не проникає крізь гематоенцефалічний бар’єр в значному об’ємі.
Біотрансформація. Ступінь біотрансформації – малий оскільки 74 % відсотки незміненої субстанції виводилося з сечею після внутрішньовенного введення здоровим добровольцям. Тіотропій як складний ефір неферментативно розпадається до спирту N-метилскопіну і дитієнілгліколевої кислоти які не зв’язуються з мускариновими рецепторами.
Далі за дослідженнями in-vitro на мікросомах печінки та гепатоцитах тіотропій (< 20 % дози після внутрішньовенного введення) метаболізується шляхом залежного від цитохрому Р450 окиснення та подальшої глутатіонової кон’югації до різноманітних метаболітів фази ІІ. Цей ферментний ланцюг може пригнічюватися інгібіторами CYP450 2D6 (та 3А4) хінидином кетоконазолом та гестоденом. Указані CYP450 2D6 та 3А4 беруть участь у метаболічних перетвореннях які відповідають за виведення меншої частини дози. Тіотропій навіть у супратерапевтичних концентраціях не інгібує цитохром Р450 1А1 1А2 2В6 2С9 2С19 2D6 2Е1 та 3А на мікросомах печінки.
Елімінація. Ефективний період напіврозпаду відбувається між 27-45 годинами у пацієнтів з ХОЗЛ. Загальний кліренс становив 880 мл/хв після внутрішньовенного введення молодим здоровим волонтерам. Після внутрішньовенного введення тіотропій головним чином виводиться з сечею у незміненому вигляді. Після інгаляції сухим порошком виділення з сечею становить 7 % (1 3 мкг) від незміненої кількості протягом 24 годин залишок не абсорбується кишечником і виводиться з калом. Нирковий кліренс тіотропію перевищує кліренс креатиніну що вказує на виділення в сечу. Після постійної щоденної інгаляції у пацієнтів із ХОЗЛ фармакокінетичний стабільний стан досягався через 7 днів без наступної кумуляції.
Лінійність/нелінійність. Тіотропій продемонстрував лінійні фармакокінетичні властивості у терапевтичному діапазоні незалежно від лікарської форми.
Фармакокінетика у пацієнтів літнього віку. Як і для всіх інших лікарських засобів які здебільшого виводяться із сечею при застосуванні тіотропію у пацієнтів літнього віку знижується нирковий кліренс (365 мл/хв у пацієнтів із ХОЗЛ < 65 років порівняно з 271 мл/хв у пацієнтів з ХОЗЛ ≥ 65 років). Це не призведе до відповідного збільшення значень AUC0-6 ss або Cmax ss.
Фармакокінетика у пацієнтів із порушеннями функції нирок. Після інгаляційного застосування тіотропію 1 раз на добу пацієнтам з ХОЗЛ у рівноважному стані легка ниркова недостатність (кліренс креатиніну 50-80 мл/хв) призвела до незначного зростання значень AUC0-6 ss (на 1 8-30 %) та схожих показників Cmax порівняно з пацієнтами з нормальною функцією нирок (кліренс креатиніну > 80 мл/хв).
У пацієнтів з ХОЗЛ із середнім або тяжким порушенням функції нирок (кліренс креатиніну <50 мл/хв) внутрішньовенне введення тіотропію призводить до збільшення вдвічі загальної експозиції (AUC0-4год вищий на 82 % і Cmax вищий на 52 %) порівняно з пацієнтами з нормальною функцією нирок що підтверджується даними про концентрацію у плазмі крові після інгаляції сухого порошку.
Фармакокінетика у пацієнтів із порушеннями функції печінки. Печінкова недостатність не має суттєвого впливу на фармакокінетику тіотропію. Тіотропій здебільшого виділяється шляхом ниркової елімінації (до 74 % у молодих здорових добровольців) та шляхом простого неферментативного розщеплення ефіру до продуктів які не зв'язуються з мускариновими рецепторами.
Пацієнти з ХОЗЛ японської нації. Під час перехресного порівняння середні максимальні концентрації тіотропію в плазмі крові через 10 хвилин після введення дози у стані рівноваги були на 20 % - 70 % вище у японських пацієнтів порівняно з європейцями після інгаляцій тіотропію але ознак підвищеної летальності або ризику ускладнень серцевих станів у японських пацієнтів порівняно з європейцями не було. Щодо інших рас або етнічних рас існує недостатньо фармакокінетичних даних
Взаємозв’язок фармококінетика/фармакодинаміка. Немає прямого взаємозв’язку між фармакокінетикою та фармакодинамікою.
Фармацевтичні характеристики.
Основні фізико-хімічні властивості: тверді желатинові капсули розміром 3 що містять білий порошок для застосування з пристроєм ХЕНДІХЕЙЛЕР.
Оболонка капсул: згідно з відповідною виробничою процедурою світло-зелена непрозора з відтиском чорного кольору символу компанії / TI 01.
термін придатності. 2 роки.
Після першого розкриття смуги блістера використати протягом 9 днів.
Умови зберігання. Зберігати при температурі не вище 25 °С. Захищати від прямих сонячних променів тепла та морозу. Зберігати у недоступному для дітей місці.
Упаковка. По 10 капсул із порошком для інгаляцій у блістері; по 3 блістери в картонній коробці.
По 10 капсул з порошком для інгаляцій у блістері; по 1 або 3 блістери в комплекті з пристроєм ХЕНДІХЕЙЛЕР у картонній коробці.
Категорія відпуску. За рецептом.
Виробник.
Берінгер Інгельхайм Фарма ГмбХ і Ко. КГ Німеччина/
Boehringer Ingelheim Pharma GmbH & Co.KG Germany.
Місцезнаходження.
Бінгер Штрассе 173 D-55216 Інгельхайм Німеччина/
Binger Strasse 173 D-55216 Ingelheim Germany.
Відгуки користувачів
Цей продукт ще не має відгуків.
Залишити відгук
Зверніть увагу
Інформація / інструкція до препарату призначена тільки в інформаційних цілях і призначена виключно в інформаційних цілях.